
| V |
| Vm |
| n |
| V |
| 8.96L |
| 22.4L/mol |
|
| 0.5mol |
| 0.2L |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
| A、该电池的负极为锌,工作时锌离子向负极移动 |
| B、该电池反应中二氧化锰起氧化剂作用 |
| C、当0.1mol Zn完全溶解时,转移电子个数为1.204×1024 |
| D、电池负极反应式为:2Mn02+2e-+2H2O=2MnO(OH)+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2LNH3和11.2LHCl混合后分子总数为NA |
| B、标准状况下,22.4LSO2与11.2LO2在催化剂作用下反应,一定生成NA个SO3分子 |
| C、标准状况下,在100ml 2mol?L-1H2SO4溶液中加入足量Na2SO3稀溶液,可收集到0.2NA个SO2气体分子 |
| D、1molFe2+ 与足量的H2O2溶液反应,转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
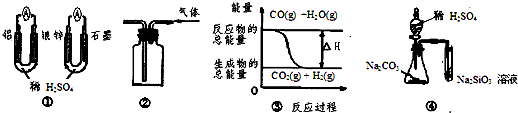
| A、图 ①两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
| B、用图 ②所示实验装置排空气法收集CO2气体 |
| C、图 ③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 |
| D、用图 ④所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| 实验后的记录: ①Zn极发生还原反应,Cu极发生氧化反应 ②H+向负极移动 ③电子流动方向Zn→导线→Cu ④溶液的pH变小 ⑤若有1mol电子流过导线,则产生H2为0.5mol. ⑥正极的电极反应式:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
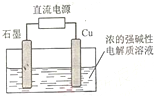 化学在能源开发与利用中起着十分关键的作用.
化学在能源开发与利用中起着十分关键的作用.
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com