
下列离子方程式不正确的是( )
A.石英与烧碱反应:SiO2+2OH-===SiO +H2O
+H2O
B.硅与烧碱反应:Si+2OH-===SiO +H2↑
+H2↑
C.硅酸钠溶液中通入少量CO2:SiO +CO2+H2O===CO
+CO2+H2O===CO +H2SiO3↓
+H2SiO3↓
D.往水玻璃中加入盐酸:2H++SiO ===H2SiO3↓
===H2SiO3↓
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.易燃试剂与强氧化性试剂分开放置并远离火源
B.用湿润的红色石蕊试纸检验氨气
C.在50 mL量筒中配制0.100 0 mol·L-1碳酸钠溶液
D.金属钠着火时,用细沙覆盖灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和另一种“反应物”在40~50 ℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧,跟盐酸反应能产生气体。下列有关推断中错误的是( )
A.这里的“另一种反应物”具有还原性
B.CuH可作氧化剂、还原剂
C.CuH+Cl2 CuCl+HCl
CuCl+HCl
D.CuH+HCl===CuCl+H2↑(常温)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是( )
甲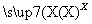 乙
乙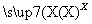 丙+甲
丙+甲
A.C和O2 B.CO2和NaOH溶液
C.Cl2和Fe D.AlCl3溶液和NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
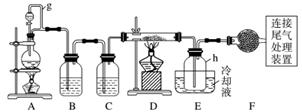
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:
________________________________________________________________________。
(2)装置A中g管的作用是____________;装置C中的试剂是__________;装置E中的h瓶需要冷却的理由是_________________________________________________
________________________________________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是______________________(填写元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲气体可发生如下变化:甲气体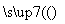 乙气体
乙气体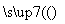 丙气体
丙气体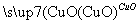 乙气体
乙气体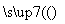 丁固体。则甲、乙、丙、丁分别为( )
丁固体。则甲、乙、丙、丁分别为( )
A.CO2、CO、O2、CaO
B.O2、CO、CO2、CaCO3
C.O2、CO2、CO、CaCO3
D.CO、CO2、O2、Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
将氯水分别滴入下列各选项所述的溶液中,由实验现象得出的结论完全正确的是( )
| 选项 | 氯水滴入下列溶液中 | 实验现象 | 结论 |
| A | 滴有KSCN的FeCl2溶液 | 变血红 | Cl2具有还原性 |
| B | 滴有酚酞的NaOH溶液 | 褪色 | Cl2具有漂白性 |
| C | 紫色石蕊溶液 | 先变红后褪色 | Cl2具有酸性、漂白性 |
| D | KI淀粉溶液 | 变蓝色 | Cl2具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl是一种化工原料,可以制备一系列物质(见下图)。下列说法正确的是( )

A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)M(g)+N(g),所得实验数据如下表:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是( )
A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min 时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com