

分析 (1)①根据CO转化率计算消耗CO物质的量,根据v=$\frac{△c}{△t}$计算v(CO),再根据速率之比等于化学计量数之比计算v(N2);
②由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比;
③正反应为气体物质的量减小的反应,为熵减反应,而△H-T△S<0反应自发进行;
④从t4时刻正反应速率不变,处于平衡状态,t4时刻前未到达平衡,反应向正反应进行,由③中可知为反应热反应,绝热条件下,随反应进行温度升高,温度起主导作用,反应速率加快,而后浓度为主导因素,反应速率减低至平衡状态;
(2)使根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数,恒温恒压下计算加入3molCO时容器体积,再计算浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
(3)①增大H2的浓度,平衡右移,CO的转化率增大;
②通过图2可知,温度升高CO的转化率降低,说明升温平衡逆向移动,故正反应方向为放热反应,则温度越高二甲醚的质量分数越小;
正反应为气体体积减小的反应,增大压强平衡正向移动,二甲醚的质量分数增大;
③A.增大反应物浓度,平衡正向移动,正反应速率先增大后减小;
B.逆反应速率先增大后减小,说明平衡逆向移动;
C.化学平衡常数K值增大,说明平衡正向移动;
D.如加入反应物,反应物的体积百分含量增大,但平衡正向移动;
E.移走生成物的量,平衡正向移动,混合气体总质量减小,容器容积不变,混合气体密度减小;
F.增大氢气的物质的量,平衡正向移动,但氢气转化率减小.
解答 解:(1)①消耗CO物质的量为1.2mol×20%=0.24mol,v(CO)=$\frac{\frac{0.24mol}{2L}}{2min}$=0.06mol/(L.min),速率之比等于化学计量数之比,则v(N2)=$\frac{1}{2}$v(CO)=0.03mol/(L.min),
故答案为:0.03mol/(L.min);
②由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比,2NO(g)+2CO(g)?2CO2(g)+N2(g)用某组分(B)的平衡压强(PB)表示平衡常数KP=$\frac{{p}^{2}(C{O}_{2})×p({N}_{2})}{{p}^{2}(NO)×{p}^{2}(CO)}$,
故答案为:=$\frac{{p}^{2}(C{O}_{2})×p({N}_{2})}{{p}^{2}(NO)×{p}^{2}(CO)}$;
③正反应为气体物质的量减小的反应,为熵减反应,△S<0,而△H-T△S<0反应自发进行,该反应在低温下能自发进行,该反应的△H<0,故答案为:<;
④从t4时刻正反应速率不变,处于平衡状态,t4时刻前未到达平衡,反应向正反应进行,由③中可知为反应热反应,绝热条件下,随反应进行温度升高,温度起主导作用,反应速率加快,而后浓度为主导因素,反应速率减低至平衡状态;
A.反应在c点未达到平衡状态,故A正确;
B.由图可知,反应速率a点小于b点,故B正确;
C.反应物浓度a点大于b点,故C正确;
D.NO的转化率:t1~t2<t2~t3,故D错误,
故选:D;
(2)温度不变,平衡常数不变,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{1}{3}}{\frac{1}{3}×(\frac{1}{3})^{2}}$=9,通入3mol CO瞬间体积变为3L×$\frac{6}{3}$=6L,浓度商Qc=$\frac{\frac{1}{6}}{\frac{4}{6}×(\frac{1}{6})^{2}}$=9=K,平衡不移动,故v(正)=v(逆),
故答案为:=;温度不变,平衡常数不变,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{1}{3}}{\frac{1}{3}×(\frac{1}{3})^{2}}$=9,通入3mol CO瞬间体积变为3L×$\frac{6}{3}$=6L,浓度商Qc=$\frac{\frac{1}{6}}{\frac{4}{6}×(\frac{1}{6})^{2}}$=9=K,平衡不移动;
(3)①增大H2的浓度,平衡右移,CO的转化率增大,故有a>b>c,
故答案为:a>b>c;
②通过图2可知,温度升高CO的转化率降低,说明升温平衡逆向移动,故正反应方向为放热反应,则温度越高二甲醚的质量分数越小,故温度:T1>T2>T3>T4;
正反应为气体体积减小的反应,增大压强平衡正向移动,二甲醚的质量分数增大,故压强P1>P2>P3>P4,
故选:BD;
③A.增大反应物浓度,平衡正向移动,正反应速率先增大后减小,不一定逆向移动,故A错误;
B.逆反应速率先增大后减小,说明平衡逆向移动,故B正确;
C.化学平衡常数K值增大,说明平衡正向移动,故C错误;
D.如加入反应物,反应物的体积百分含量增大,但平衡正向移动,故D错误;
E.移走生成物的量,平衡正向移动,混合气体总质量减小,容器容积不变,混合气体密度减小,故E错误;
F.增大氢气的物质的量,平衡正向移动,但氢气转化率减小,故F错误,
故选:B.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、平衡状态建立、反应速率计算、平衡常数应用等,式对学生综合能力考查,难度中等,(2)为易错点,学生容易忽略体积变化.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:4 | D. | 5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥ | B. | ③⑥ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 煤和水煤气均是二次能源 | |
| B. | 煤中含有苯、甲苯、二甲苯等有机物 | |
| C. | ①是将煤在空气中加强热使其分解的过程 | |
| D. | B为甲醇或乙酸时,原子利用率均达到100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “APEC蓝”是2014年新的网络词汇,形容2014年APEC会议期间北京蓝蓝的天空.说明京津冀实施道路限行和污染企业停工等措施,对减轻雾霾、保证空气质量是有效的 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 有机垃圾发酵生产沼气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
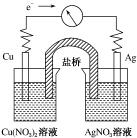 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | Cu作负极,发生还原反应 | |
| C. | 电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液 | |
| D. | 工作一段时间后,AgNO3溶液中c(Ag+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的热化学方程式为: $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),△H=-92kJ•mol-1 | |
| B. | 不用催化剂,生成 1molNH3放出的热量为46 KJ | |
| C. | 加入催化剂,生成 1molNH3的反应热减小50 KJ•mol-1 | |
| D. | 在温度体积一定的条件下,通入1molN2和3molH2,反应后放出的热量为Q1,若通入2molN2和6molH2,反应后放出的热量为Q2,则Q1=0.5Q2<92KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com