
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:

已知:还原性:Cl>Co2+;
回答下列问题:
(1)废旧电池初步处理为粉末状的目的是___________。
(2)从含铝废液得到Al(OH)3的离子方程式为________。
(3)滤液A中的溶质除HCl、LiCl外还有FeCl3、CoCl2。写出LiCoO2和盐酸反应的化学方程式_______。
(4)滤渣的主要成分为______(填化学式)。
(5)已知Li2CO3的溶度积常数Ksp=8.64×104,将浓度为0.02mol·L1的Li2SO4和浓度为0.02 mol·L1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L1。
(6)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是________。
【答案】增大接触面积,加快反应速率,提高浸出率 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 2LiCoO2+8HCl=2CoCl2+Cl2↑+4H2O+2LiCl C 0.02 加入适量盐酸(或通入适量氯化氢气体)
【解析】
废旧钴酸锂镍离子电池主要含有Fe、Al、碳的单质和LiCoO2,初步处理,加碱浸泡,铝和碱液反应生成偏铝酸盐和氢气,固体残渣为:Fe、C的单质和LiCoO2,加盐酸Fe+2H+=Fe2++H2↑,2LiCoO2+8H++2Cl-=2Li++2Co2++Cl2↑+4H2O,沉淀为C,滤液A为Fe3+、Li+、Co3+、Cl-,加入草酸铵,过滤沉淀为CoC2O42H2O,滤液B为:Fe3+、Li+、Cl-,加入碳酸钠,发生的离子反应为2Li++CO32-=Li2CO3↓,滤液C为Fe3+、Cl-,加入氧化剂防止铁离子被还原得氯化铁溶液,据此分析解答。
(1)废旧电池初步处理为粉末状的目的是:增大接触面积,加快反应速率,提高浸出率;
(2)从含铝废液得到Al(OH)3的离子反应方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)LiCoO2中Li为+1价,Co为+3价,具有氧化性,HCl中-1价的氯具有还原性,向固体残渣中加入盐酸时,Co(+3→+2),Cl(-1→0),最小公倍数为1,因Cl2为双原子分子,所以LiCoO2前系数为2,根据原子守恒,未知物为水,所以反应为:2LiCoO2+8HCl=2LiCl+2CoCl2+Cl2↑+4H2O;
(4)上述分析可知,滤渣的主要成分为C;
(5)将浓度为0.02molL-1的Li2SO4和浓度为0.02molL-1的Na2CO3溶液等体积混合,计算得到溶液中c(Li+)=0.02mol/L,c(CO32-)=0.01mol/L,计算浓度商Qc=c2(Li+)×c(CO32-)=4×10-6<Ksp=8.64×10-4,无沉淀生成,则此时溶液中Li+浓度为0.02mol/L;
(6)氯化铁溶液中氯化铁水解生成氢氧化铁和氯化氢,氯化氢是易挥发的物质,加热会促进水解生成氢氧化铁,从FeCl3溶液得到FeCl36H2O固体的操作关键是抑制氯化铁水解,加入适量盐酸(或通入适量氯化氢气体)。


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.7.8g苯所含碳碳双键数目为0.3NAB.28g乙烯所含共用电子对数目为5NA
C.标准状况下,11.2L乙醇所含分子数为0.5NAD.16g甲烷电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是短周期元素中原子半径最小的元素,乙的气态氢化物的水溶液显碱性,丙是短周期元素中原子半径最大的元素,丁是地壳中含量最多的金属元素。
(1)写出四种元素的名称:甲______,乙______,丙______,丁______。
(2)乙、丙、丁三种元素的原子半径从大到小的顺序是________(填元素符号,下同)![]() ________
________![]() ________。
________。
(3)写出乙、丙、丁的最高价氧化物对应的水化物相互反应的化学方程式:__________________、__________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源开发前景十分广阔。海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线。则下列说法不正确的是

A.t1℃时,三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
B.t1℃时,分别在100g水中溶解了等质量的MgCl2、KCl,两溶液都可达到饱和
C.t2℃时,KCl和MgSO4两种物质的溶解度相同
D.将卤水加热到t2℃ 以上,析出的晶体主要为MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相等.将1.0体积这种混合气体在氧气中完全燃烧,生成2.0体积的CO2和2.4体积的水蒸气(气体体积均在相同状况下测定),则混合气体中烷烃和烯烃的体积比为( )
A.3:1 B.1:3 C.2:3 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机化合物中,不论两者以什么比例混合,只要总物质的量一定,则完全燃烧时消耗氧气的质量不变的是( )
A.CH4O,C3H4O5,C2H4O2B.C3H6,C3H8O,C4H8O3
C.C3H8,C4H6,C4H8OD.C2H6,C4H6O,C3H8O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
①离子化合物中一定有离子键,一定没有共价键
②NaHSO4固体中阳离子和阴离子的个数比是1:1
③共价化合物中不含离子键,一定只含共价键
④稳定性:H2O>H2S,沸点:H2O<H2S
⑤NaCl和HCl溶于水破坏相同的作用力
⑥非极性键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
A.①②⑥B.①③④⑥C.②③⑥D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如右图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:
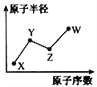
(1)写出四种元素的元素符号:X____ Y____ Z____ W____
(2)HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确___,说明理由__________________________________。
(3)甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有漂白消毒杀菌作用,其化学式为________;化合物乙是一种常见的强酸,会因保存不当而变成黄色液体,其原因是_______________________________。把红热的木炭投入黄色液体,剧烈反应,方程式为_____________________,将产生的气体通过澄清石灰水时气体变为无色,但未见有浑浊现象,原因是______________。(写出有关反应的化学方程式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com