
| A. | 0.10mol•L-1的醋酸溶液和0.01mo•L-1的醋酸溶液中水的电离度 | |
| B. | 将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量 | |
| C. | 物质的量浓度相等的(NH4)2SO4溶液和(NH4)2SO3溶液中NH4+的浓度 | |
| D. | 物质的量浓度相等的CH3COONa溶液和 Na2CO3溶液的pH |
分析 A、0.10mol•L-1的醋酸溶液比0.01mo•L-1的醋酸溶液对水的水电离抑制程度大;
B、盐酸是强酸,醋酸是弱酸,稀释促进水的电离;
C、浓度相等的(NH4)2SO4溶液和(NH4)2SO3溶液都能完全电离出完全一样的铵根离子;
D、醋酸根离子的水解程度小于碳酸根离子的水解程度.
解答 解:A、0.10mol•L-1的醋酸溶液比0.01mo•L-1的醋酸溶液对水的水电离抑制程度大,所以0.10mol•L-1的醋酸溶液比0.01mo•L-1的醋酸溶液中水的电离度小,故A错误;
B、盐酸是强酸,醋酸是弱酸,稀释促进水的电离,将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量是后者大,故B错误;
C、浓度相等的(NH4)2SO4溶液和(NH4)2SO3溶液都能完全电离出完全一样的铵根离子,但是昂嗯呵亚硫酸根离子的水解相互促进,所以NH4+的浓度前者大,故C正确;
D、物质的量浓度相等的CH3COONa溶液和 Na2CO3溶液的pH是后者大,故D错误;
故选C.
点评 本题考查了盐类水解、弱电解质电离平衡的分析判断和影响因素的分析,掌握基础是关键,题目较简单.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:解答题
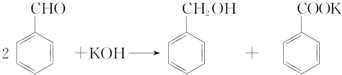
| 名称 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 |
| 苯甲醛 | 无色液体,苦杏仁味 | -26 | 178.1 | 1.041 5 | 微溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4 | 248 | 1.265 9 | 微溶 |
| 苯甲醇 | 无色液体,有芳香味 | -15.3 | 205.35 | 1.041 9 | 微溶 |
| 乙醚 | 无色透明液体, 有特殊刺激性气味 | -116.3 | 34.6 | 0.71 | 不溶 |
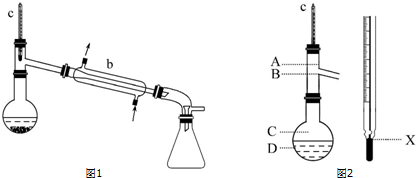
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色一氧化氮气体与空气接触变为红棕色 | |
| B. | 往盐酸中滴加紫色石蕊试液,溶液变红色 | |
| C. | 向硫酸铜溶液中滴加氢氧化钠溶液,出现白色沉淀 | |
| D. | 将足量二氧化硫气体通入品红溶液,红色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L10mol/L浓盐酸与10L水混合 | |
| D. | 10gNaOH固体溶解在水中配成250mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol OH-含有7NA个电子 | |
| B. | 0.012kg碳中所含有的碳原子数为NA | |
| C. | 10g46%的乙醇溶液含O数为0.4NA | |
| D. | 0.5mol/L碳酸钠中含有的Na+为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com