
·ÖĪö £Ø1£©øł¾Ż»ÆŗĻ¼ŪµÄ“śŹżŗĶĪŖĮć¼ĘĖć£»
£Ø2£©øł¾Ż»ÆŗĻĪļÖŠĢśĄė×ÓŗĶĀĮĄė×ÓµÄĖ®½ā³Ģ¶Č·ÖĪö£»
£Ø3£©ŅŃÖŖ·¢ÉśµÄ·“Ó¦ĪŖ£ŗ2FeCl3+SnCl2=2FeCl2+SnCl4£¬SnCl2+2HgCl2=SnCl4+Hg2Cl2£¬6FeCl2+K2Cr2O7+14HCl=6FeCl3+2CrCl3+2KCl+7H2O£¬
øł¾Ż6FeCl3”«6FeCl2”«K2Cr2O7£¬ÓÉK2Cr2O7µÄĪļÖŹµÄĮæ¼ĘĖćĢśĄė×ÓµÄĪļÖŹµÄĮ棬øł¾ŻŌŖĖŲŹŲŗć¼ĘĖćŃõ»ÆĢśµÄÖŹĮ棬ŌŁøł¾Ż¹ĢĢå3.420g£¬Ēó³öŃõ»ÆĀĮµÄÖŹĮæŗĶĀĮµÄĪļÖŹµÄĮæ£¬Č»ŗóĒó³öѳʷ֊µÄn£ØFe3+£©£ŗn£ØAl3+£©£®
½ā“š ½ā£ŗ£Ø1£©FeaAlb£ØOH£©cCldÖŠFeĪŖ+3¼Ū£¬AlĪŖ+3¼Ū£¬HĪŖ+1¼Ū£¬OĪŖ-2¼Ū£¬ÓÉŌŖĖŲ»ÆŗĻ¼ŪµÄ“śŹżŗĶĪŖĮćæÉµĆ£¬3a+3b+c+£Ø-2£©c+£Ø-1£©d=0£¬¼“d=3a+3b-c£»
¹Ź“š°øĪŖ£ŗ3a+3b-c£»
£Ø2£©ÓÉ[FeaAlb£ØOH£©cCld]mµÄ»ÆѧŹ½æÉÖŖ£¬ĘäĖ®½āÉś³ÉµÄĒāĄė×Ó±ČĀČ»ÆĀĮ»ņĀČ»ÆĢśĖ®½āŗóÉś³ÉµÄĒāĄė×ÓÉŁ£¬ČÜŅŗµÄĖįŠŌČõ£¬¶Ō±¾ÉķĖ®½āµÄŅÖÖĘ³Ģ¶ČŠ”£¬Ė®½ā³Ģ¶Č“ó£¬Ė®½āÉś³ÉµÄĒāŃõ»ÆĢś»ņĒāŃõ»ÆĀĮµÄĪļÖŹµÄĮæ“ó£¬ĖłŅŌ¾ŪŗĻĀČ»ÆĀĮĢś¾»Ė®µÄŠŌÄÜÓÅÓŚĀČ»ÆĀĮŗĶĀČ»ÆĢś£»
¹Ź“š°øĪŖ£ŗ¾ŪŗĻĀČ»ÆĀĮĢśĖ®½āŗ󣬱ČĀČ»ÆĀĮ»ņĀČ»ÆĢśĖ®½āŗóµÄČÜŅŗĖįŠŌČõ£¬¶Ō±¾ÉķĖ®½āµÄŅÖÖĘ³Ģ¶ČŠ”£»
£Ø3£©ŅŃÖŖ·¢ÉśµÄ·“Ó¦ĪŖ£ŗ2FeCl3+SnCl2=2FeCl2+SnCl4£¬SnCl2+2HgCl2=SnCl4+Hg2Cl2£¬6FeCl2+K2Cr2O7+14HCl=6FeCl3+2CrCl3+2KCl+7H2O£¬
øł¾Ż6FeCl3”«6FeCl2”«K2Cr2O7£¬æÉÖŖ£¬
n£ØFe3+£©=6n£ØK2Cr2O7£©=6”Į0.0100mol•L-1”Į0.0100L=6.000”Į10-4mol£¬
Ōņ500mLČÜŅŗn£ØFe3+£©=6.000”Į10-4mol”Į$\frac{500mL}{10mL}$=0.0300 mol£¬
×¼Č·³ĘČ”5.745gѳʷ£¬¼ÓČė×ćĮæµÄŃĪĖį³ä·ÖČܽā£¬Č»ŗó¼ÓČė×ćĮæ°±Ė®£¬¹żĀĖ”¢Ļ“µÓ”¢×ĘÉÕ£¬µĆ¹ĢĢå3.420g£¬øĆ¹ĢĢåĪŖŃõ»ÆĢśÓėŃõ»ÆĀĮ£¬
ĘäÖŠn£ØFe2O3£©=$\frac{1}{2}$n£ØFe3+£©=0.0150 mol£¬
Ōņ m£ØFe2O3£©=0.0150 mol”Į160 g•mol-1=2.400 g£¬
ĖłŅŌm£ØAl2O3£©=3.420 g-2.400 g=1.020 g£¬n£ØAl2O3£©=$\frac{1.020g}{102g•mo{l}^{-1}}$=0.0100mol£¬n£ØAl3+£©=0.0200 mol£¬
n£ØFe3+£©£ŗn£ØAl3+£©=0.0300 mol£ŗ0.0200 mol=3£ŗ2
“š£ŗ¾ŪŗĻĀČ»ÆĀĮĢśŃłĘ·ÖŠµÄn£ØFe3+£©£ŗn£ØAl3+£©ĪŖ3£ŗ2£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»ÆŗĻĪļÖŠ»ÆŗĻ¼ŪµÄ¹ŲĻµ”¢ŃĪµÄĖ®½ā”¢ĪļÖŹŗ¬ĮæµÄ²ā¶Ø¼°ÓŠ¹Ų¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬²ąÖŲÓŚæ¼²éѧɜµÄ¼ĘĖćÄÜĮ¦ŗĶ·ÖĪöÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÕōĮóŹµŃ鏱ĻņÕōĮóÉÕĘæÖŠ·ÅČė¼øĮ£·ŠŹÆ£Ø»ņĖé“Éʬ£© | |
| B£® | ½šŹōÄĘ×Å»šŹ±Ź¹ÓĆÅŻÄĆš»šĘ÷Ćš»š | |
| C£® | ÓĆŹŌ¹Ü¼ÓČČĢ¼ĖįĒāÄĘ¹ĢĢåŹ±Ź¹ŹŌ¹ÜæŚĀŌĻņÉĻĒ抱 | |
| D£® | ÅØĮņĖį½¦µ½Ę¤·ōÉĻĮ¢¼“ÓĆĻ”ĒāŃõ»ÆÄĘČÜŅŗ³åĻ“ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ŗĻ©”¢±½”¢±½·Ó | B£® | ŅŅČ©”¢ŅŅĖį”¢ŅŅ“¼ | C£® | ŅŅĖį”¢ŅŅ“¼”¢±½·Ó | D£® | ŅŅĶ锢ŅŅĻ©”¢ŅŅČ² |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
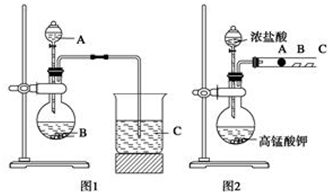
 ŅŅ¶žĖįĖ×Ćū²ŻĖį£¬ĻĀĆęŹĒ»ÆѧѧĻ°Š”×éµÄĶ¬Ń§¶Ō²ŻĖį¾§Ģå£ØH2C2O4•xH2O£©½ųŠŠµÄĢ½¾æŠŌѧĻ°µÄ¹ż³Ģ£¬ĒėÄć²ĪÓė²¢ŠÖśĖūĆĒĶź³ÉĻą¹ŲѧĻ°ČĪĪń£®øĆ×éĶ¬Ń§µÄŃŠ¾ææĪĢāŹĒ£ŗĢ½¾æ²ā¶Ø²ŻĖį¾§Ģå£ØH2C2O4•xH2O£©ÖŠxÖµ£®Ķعż²éŌÄ׏ĮĻŗĶĶųĀē²éŃ°µĆ£¬²ŻĖįŅ×ČÜÓŚĖ®£¬Ė®ČÜŅŗæÉŅŌÓĆĖįŠŌKMnO4ČÜŅŗ½ųŠŠµĪ¶Ø£ŗ2MnO${\;}_{4}^{-}$+5H2C2O4+6H+ØT=2Mn2++10CO2”ü+8H2OѧĻ°Š”×éµÄĶ¬Ń§Éč¼ĘĮĖµĪ¶ØµÄ·½·Ø²ā¶ØxÖµ£®
ŅŅ¶žĖįĖ×Ćū²ŻĖį£¬ĻĀĆęŹĒ»ÆѧѧĻ°Š”×éµÄĶ¬Ń§¶Ō²ŻĖį¾§Ģå£ØH2C2O4•xH2O£©½ųŠŠµÄĢ½¾æŠŌѧĻ°µÄ¹ż³Ģ£¬ĒėÄć²ĪÓė²¢ŠÖśĖūĆĒĶź³ÉĻą¹ŲѧĻ°ČĪĪń£®øĆ×éĶ¬Ń§µÄŃŠ¾ææĪĢāŹĒ£ŗĢ½¾æ²ā¶Ø²ŻĖį¾§Ģå£ØH2C2O4•xH2O£©ÖŠxÖµ£®Ķعż²éŌÄ׏ĮĻŗĶĶųĀē²éŃ°µĆ£¬²ŻĖįŅ×ČÜÓŚĖ®£¬Ė®ČÜŅŗæÉŅŌÓĆĖįŠŌKMnO4ČÜŅŗ½ųŠŠµĪ¶Ø£ŗ2MnO${\;}_{4}^{-}$+5H2C2O4+6H+ØT=2Mn2++10CO2”ü+8H2OѧĻ°Š”×éµÄĶ¬Ń§Éč¼ĘĮĖµĪ¶ØµÄ·½·Ø²ā¶ØxÖµ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.02 mol•L-1“×ĖįÓė0.02 mol•L-1NaOHµČĢå»ż»ģŗĻŗóµÄČÜŅŗÖŠ¼ÓÉŁĮæµÄCH3COONa¹ĢĢåŌņ$\frac{c£ØC{H}_{3}CO{O}^{-}£©}{c£ØN{a}^{+}£©}$Ōö“ó | |
| B£® | ³£ĪĀĻĀ£¬·“Ó¦C£Øs£©+CO2£Øg£©ØT2CO£Øg£©²»ÄÜ×Ō·¢½ųŠŠ£¬ŌņøĆ·“Ó¦µÄ”÷H£¾0 | |
| C£® | lmol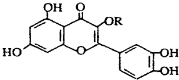 ÓėNaOHČÜŅŗ×÷ÓĆĻūŗÄNaOHµÄĪļÖŹµÄĮæŅŌ¼°ÓėĒāĘų¼Ó³ÉĖłŠčµÄĒāĘųµÄĪļÖŹµÄĮæ·Ö±šŹĒ4 mol”¢8 mol ÓėNaOHČÜŅŗ×÷ÓĆĻūŗÄNaOHµÄĪļÖŹµÄĮæŅŌ¼°ÓėĒāĘų¼Ó³ÉĖłŠčµÄĒāĘųµÄĪļÖŹµÄĮæ·Ö±šŹĒ4 mol”¢8 mol | |
| D£® | ŗģĶā¹āĘ×·ÖĪö²»ÄÜĒų·ÖŅŅ“¼ŗĶŅŅĆŃ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | MgŗĶAl¶¼æÉŅŌÓƵē½ā·ØŅ±Į¶µĆµ½ | |
| B£® | MgŗĶFeŌŚŅ»¶ØĢõ¼žĻĀÓėĖ®·“Ó¦¶¼Éś³ÉH2 ŗĶ¶ŌÓ¦µÄ¼ī | |
| C£® | FeŗĶCu³£ĪĀĻĀ·ÅČėÅØĻõĖįÖŠ·¢ÉśµÄĻÖĻóĻąĶ¬ | |
| D£® | Na2OŗĶNa2O2ÓėCO2·“Ó¦²śĪļŅ²ĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com