
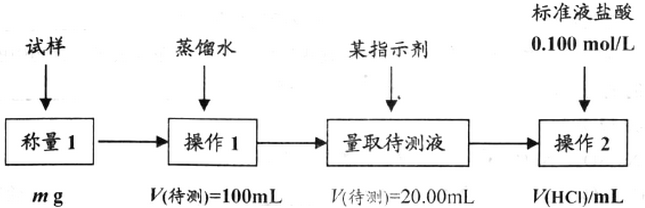
分析 (1)根据天平的感量确定称量仪器,当前后两次称量的质量差不超过0.001g时说明已经达到恒重;
(2)根据一定物质的量浓度溶液的配制步骤选取实验仪器;
(3)甲基橙的变色范围是3.1-4.4,碳酸钠溶液呈碱性,所以滴有甲基橙的碳酸钠溶液呈黄色,当滴定终点时,溶液黄色恰好变成橙色;
(4)为减少误差,应多做几次实验取平均值;
(5)能影响溶质物质的量的因素影响测定结果,否则不影响测定结果;
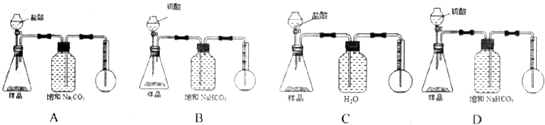
(6)方案三根据二氧化碳和碳酸钠的关系式计算其质量分数;
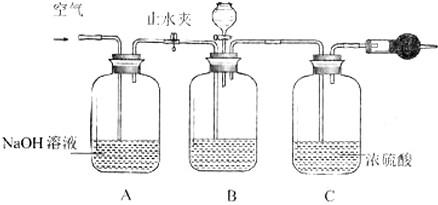
(7)空气中的水蒸气会进入干燥管导致二氧化碳的质量偏大;在干燥管后加一装有碱石灰的干燥管,吸收空气中的水和二氧化碳;
(8)用排溶液的方法测量气体体积,导管应该是“短进长出”,且所用溶液不能和二氧化碳反应.
解答 解:(1)方案一 托盘天平的过量是0.1g,电子天平的感量是0.001g,所以称量药品时用电子天平,当前后两次称量的质量差不超过0.001g时说明已经达到恒重,
故答案为:电子天平;前后两次称量的质量差不超过0.001g;
(2)方案二①配制一定物质的量浓度溶液时,用烧杯溶解固体药品,用玻璃棒搅拌固体溶解和引流溶液,用容量瓶配制溶液,用胶头滴管定容,
故答案为:烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(3)甲基橙的变色范围是3.1-4.4,碳酸钠溶液呈碱性,所以滴有甲基橙的碳酸钠溶液呈黄色,当滴定终点时,溶液呈酸性,溶液黄色恰好变成橙色,且半分钟内不褪色,
故答案为:黄色恰好变成橙色,且半分钟内不褪色;
(4)为减少误差,应多做几次实验取平均值,即做2-3次平行实验,
故答案为:做2-3次平行实验;
(5)滴定时若锥形瓶内有少量液体溅出,导致锥形瓶内溶液中溶质减少,所以测定结果偏低,若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,对锥形瓶内溶液中的溶质无影响,所以测定结果无影响,
故答案为:偏低;无影响;
(6)碱石灰吸收的物质是二氧化碳,二氧化碳的质量是(W2-W1)g,根据碳原子守恒得碳酸钠的质量=$\frac{106({m}_{2}-{m}_{1})}{44}$,
则纯碱的质量分数=$\frac{53({m}_{2}-{m}_{1})}{22a}$;
故答案为:$\frac{53({m}_{2}-{m}_{1})}{22a}$;
(7)空气中的水蒸气会进入干燥管导致二氧化碳的质量偏大,则碳酸钠的质量偏大,计算结果偏高;空气中的水蒸气进入干燥管而影响二氧化碳的测定,为防止水蒸气的干扰,应该在干燥管右边再加一个装有碱石灰的干燥管,
故答案为:偏高;在干燥管右边再加一个装有碱石灰的干燥管;
(8)用排溶液的方法测量气体体积,导管应该是“短进长出”,即进气管长度小于出液管长度,且所用溶液不能和二氧化碳反应,碳酸氢钠中含有碳酸氢根离子能抑制二氧化碳的溶解,
故答案为:D.
点评 本题主要考查了物质含量测定方法,掌握实验原理是解题的关键,需要注意的是二氧化碳和水蒸气对二氧化碳的测定有影响,所以为防止干扰要先除去空气中二氧化碳和水蒸气,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 方案Ⅱ比方案Ⅰ操作简便 | |
| B. | 等质量的锌,相同条件下方案Ⅰ和方案Ⅱ中制得的铜的质量相同 | |
| C. | 等质量的H2SO4参加反应,方案Ⅰ制取铜的质量比方案Ⅱ的少 | |
| D. | 为了加快锌与稀硫酸反应,可以在溶液中加入少量氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 | |
| B. | 气态氢化物的热稳定性:M>N | |
| C. | M与X的化合物对应的水化物一定是强酸 | |
| D. | 离子半径r:r(X2-)>(r+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C$\stackrel{在空气中点燃}{→}$CO$\stackrel{CuO,△}{→}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3 | |
| B. | Cu$\stackrel{AgNO_{3}溶液}{→}$Cu(NO3)2溶液$\stackrel{NaOH溶液}{→}$Cu(OH)2 | |
| C. | Fe$\stackrel{点燃}{→}$Fe2O3$\stackrel{H_{2}SO_{4}溶液}{→}$Fe2(SO4)3溶液 | |
| D. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2溶液$\stackrel{Na_{2}CO_{3}}{→}$NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;水杨酸与小苏打溶液反应的化学方程式:
;水杨酸与小苏打溶液反应的化学方程式: ; 一定条件下,C与F反应的反应类型是_酯化反应.
; 一定条件下,C与F反应的反应类型是_酯化反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①③④ | B. | ②③④① | C. | ④②③① | D. | ④③①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com