
| A. | 标准状况下,2.24L SO3中含有的SO3分子数为0.1NA | |
| B. | 5.6 g Fe与标准状况下2.24L的Cl2充分反应,转移的电子数为0.3NA | |
| C. | 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L | |
| D. | 1molMnO2与4mol浓盐酸充分反应后生成的Cl2分子数为NA |
分析 A.标准状况下,SO3不是气体;
B.发生2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,Cl2不足完全反应;
C.含3NA个离子的Na2O2固体,物质的量为1mol,含钠离子为2mol;
D.随反应的进行,浓盐酸变为稀盐酸,稀盐酸与二氧化锰不反应.
解答 解:A.标准状况下,SO3不是气体,则不能利用体积计算物质的量,故A错误;
B.发生2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,Cl2不足完全反应,则转移的电子数为0.2NA,故B错误;
C.含3NA个离子的Na2O2固体,物质的量为1mol,含钠离子为2mol,则溶于水配成1L溶液,所得溶液中Na+的浓度为$\frac{2mol}{1L}$=2mol/L,故C正确;
D.随反应的进行,浓盐酸变为稀盐酸,稀盐酸与二氧化锰不反应,则1molMnO2与4mol浓盐酸充分反应后生成的Cl2分子数小于NA,故D错误;
故选C.
点评 本题考查物质的量的有关计算,为高频考点,把握质量、体积、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意物质的性质及基本计算公式的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有N | B. | 只有S | C. | 只有C | D. | N和S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3 | B. | CH3CH(CH3)CH2CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.该烷烃的一氯代物最多有4种.
的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.该烷烃的一氯代物最多有4种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
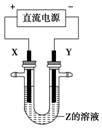 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 若Z是稀硫酸,X为铜,Y为铁,则铁不溶解,该方法为外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com