
| A. | 乙烯与HBr发生加成反应 | B. | 苯发生硝化反应 | ||
| C. | 乙烯合成聚乙烯 | D. | 乙醇催化氧化生成乙醛 |
分析 A.发生加成反应,碳碳双键转化为-Br;
B.苯中H被硝基取代;
C.碳碳双键转化为单键;
D.催化氧化反应中-OH转化为-CHO.
解答 解:A.发生加成反应,碳碳双键转化为-Br,官能团在反应前后均只有一种,故A不选;
B.苯中H被硝基取代,硝基为官能团,官能团由0增加为1,故B选;
C.碳碳双键转化为单键,官能团由1减少为0,故C不选;
D.催化氧化反应中-OH转化为-CHO,官能团在反应前后均只有一种,故D不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注重迁移应用能力的训练,注意有机反应及官能团变化,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
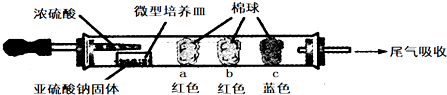
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: 2OHˉ+SO2=SO32ˉ+H2O 或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 结论:该气体具有还原 性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbCO3 | B. | 2PbCO3•Pb(OH)2 | C. | Pb(OH)2 | D. | (CH3COO)2Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
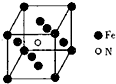 氮、硫、氯、钠、铝、铁及其化合物是研究基本概念和基本理论的重要载体.
氮、硫、氯、钠、铝、铁及其化合物是研究基本概念和基本理论的重要载体.| 性质 | 第一电离能 | 熔点 | 半径 | 键能 |
| 对象 | S<Cl | Na<Al | N3->Al3+ | N=N<N≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇用作医用消毒剂时,无水乙醇消毒效果最好 | |
| B. | 高锰酸钾溶液可以杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理不同 | |
| C. | 公益调查《柴静雾霾调查:穹顶之下》发布,其中雾霾中的PM2.5属于胶体 | |
| D. | 天津港爆炸案中对剧毒的氰化钠(NaCN) 喷洒双氧水处理,利用了双氧水的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C(I-)/(mol•L-1) | C(Fe3+)/(mol•L-1) | ν/(mol•(L•s)-1) | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com