
【题目】已知
Fe(s)+CO2(g)![]() FeO(s)+CO(g) K1 ①
FeO(s)+CO(g) K1 ①
Fe(s)+H2O(g)![]() FeO(s)+H2(g) K2 ②
FeO(s)+H2(g) K2 ②
H2(g)+CO2(g)![]() H2O(g)+CO(g)K3 ③
H2O(g)+CO(g)K3 ③
又已知不同温度下,K1、K2值如右表:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)判断反应③达到化学平衡状态的依据是____________。
a.混合气体的平均摩尔质量不变
b.混合气体中c(CO)不变
c.v(H2O)正=v(H2)逆
d.断裂2 mol H—O键的同时生成1 mol H—H键
(2)若500 ℃时进行反应①,CO2起始浓度为2 mol·L-1,2分钟后建立平衡,则CO2转化率为________,用CO表示的速率为________________。
(3)下列图象不符合反应②的是___________(填序号)(图中v是速率,φ为混合物中H2的体积百分含量)。

(4)900 ℃进行反应③,其平衡常数K3为____________(求具体数值),焓变ΔH__________0(填“>”“=”或“<”),理由是 。
【答案】(1)bc(2)50%;0.5 mol·L-1·min-1(3)A
(4)1.50;>;500℃时K3=1/3.15,900℃K3=1.5,说明温度升高,平衡正向移动,K增大,正反应是吸热反应。或温度升高,K1增大,K减小,则△H1>0,则△H2<0,△H3= △H1-△H2>0。
【解析】试题分析:(1)a.由方程式可知反应③反应前后混合气体的总质量和总物质的量不变,所以平均摩尔质量不变不能作为判断达到平衡的依据,故a不正确;b.混合气体中c(CO)不变说明正逆反应速率相等,该反应已经达到了化学平衡状态,故B正确;c.该反应中水与氢气的化学计量数相等,所以v(H2O)正=v(H2)逆说明正逆反应速率相等,该反应已经达到了化学平衡状态,故c正确;d.根据化学方程式可知,断裂2 mol H-O键的同时一定生成1 mol H-H键,与化学平衡无关,故D错误。故答案为:bc;
(2)反应Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数k=c(CO)/c(CO2)=1,由表中数据可知,对于反应①,令平衡时参加反应的二氧化碳的物质的量浓度减小为xmol/L,则:
Fe(s)+CO2(g)═FeO(s)+CO(g)
c开始(mol/L): 2 0
c变化(mol/L): x x
c平衡(mol/L): 2-x x
所以x/(2-x)=1,解得x=1,故二氧化碳的转化率为1mol/L÷2mol/L×100%=50%;
CO表示的平均速率v(CO)= 2mol/L÷2min=1mol/(Lmin)。
故答案为:50%;1mol/(Lmin);
(3)A.由图可知,升高温度,平衡向正反应移动,故图象表示正反应吸热反应,反应②正反应是放热反应,图象与实际不相符合,故A选;B.由图可知,最高点到达平衡,温度升高,混合物中氢气的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,反应②正反应是放热反应,图象与实际相符,故B不选;C.由图可知,温度T2先到达平衡,故温度T2>T1,随温度升高达到平衡时,混合物中氢气的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,反应①正反应是放热反应,图象与实际相符,故C不选;D.由于铁为固体,其他条件不变时,增加铁的量化学反应速率基本不变,故D不选。
故答案为:A;
(4)根据勒夏特列原理可知,化学反应①-②=③,所以900℃时,K3=K1/K2=2.4÷1.6=1.5。500℃时K3=1/3.15,900℃K3=1.5,说明温度升高,平衡正向移动,K增大,正反应是吸热反应,即900℃时,△H>0。或温度升高,K1增大,K2减小,则△H1>0,则△H2<0,△H3= △H1-△H2>0。故答案为:1.50;>;500℃时K3=1/3.15,900℃K3=1.5,说明温度升高,平衡正向移动,K增大,正反应是吸热反应。或温度升高,K1增大,K减小,则△H1>0,则△H2<0,△H3= △H1-△H2>0。


科目:高中化学 来源: 题型:
【题目】某一元弱酸(用HA表示)在水中的电离方程式是:HA![]() H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向___________(填“正”、“逆”)反应方向移动。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向___________(填“正向”、“逆向”、或“不移动”)移动,溶液pH将___________中(填“增大”、“减小”或“不变”),溶液中![]() 比值___________(填“增大”、“减小”或“不变”).
比值___________(填“增大”、“减小”或“不变”).
(3)在25℃下,将a molL-1的氨水与0.01molL-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液呈中性,用含a的代数式表示NH3H2O的电离常数Kb=___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归类正确的是
A. 液氯、水玻璃均为混合物 B. 液氨、干冰均为化合物
C. 醋酸、P2O5均为电解质 D. Na2O2、Na2SiO3均为钠盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是 ( )
A. 加热 B. 将稀硫酸改为98%的浓硫酸
C. 滴加少量CuSO4溶液 D. 铁片改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是
A. 强碱性溶液中:K+、AlO2-、Cl-、SO42-
B. 强酸性溶液中:K+、SO42-、Fe2+、NO3-
C. 与铝反应产生大量氢气的溶液中:Na+、CO32-、NO3-、K+
D. 某无色溶液中:Fe3+、Cl-、Na+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验方法和实验装置均正确的是



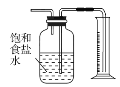
甲 乙 丙 丁
A.用甲装置实现从溴水中萃取溴
B.用乙装置盛放饱和Na2CO3溶液可除去CO2中混有的SO2
C.用丙装置加热CuCl2溶液,制取CuCl2固体
D.用丁装置测量浓盐酸与MnO2反应所得氯气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸微溶于水,熔点122.4℃、沸点248℃。实验室用甲苯和高锰酸钾溶液反应,方程式为C6H5—CH3+KMnO4![]() C6H5—COOK,制得苯甲酸钾,然后再酸化,制得苯甲酸。装置如图所示(部分夹持装置已略去):
C6H5—COOK,制得苯甲酸钾,然后再酸化,制得苯甲酸。装置如图所示(部分夹持装置已略去):

(1)实验时,把1.84 g C6H5—CH3和4.5 g KMnO4、适量蒸馏水加入三颈瓶,用搅拌器搅拌的目的是________________________。加热至沸腾,冷凝管中的水应从_____口进(填“a”或“b”)。
(2)加热一段时间后,直到甲苯层几乎近于消失,回流液不再出现油珠,此时反应混合液仍为紫色,停止加热,从分液漏斗慢慢加入适量饱和亚硫酸钠溶液,实验现象为________________________,该反应有一种碱、一种盐和二氧化锰生成,化学方程式为________________________,该反应中氧化产物为__________(填化学式),若有1 mol二氧化锰生成,转移_____mol电子。
(3)将反应混合物趁热过滤,把滤液和洗涤液混合,冷却,用浓盐酸酸化,发生反应的化学方程式为:_____________________________。
(4)将苯甲酸洗涤、干燥、称重,得1.71 g苯甲酸,本实验中苯甲酸的产率为_____%(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com