
【题目】对应下列叙述的微粒M和N,肯定属于同主族元素且化学性质相似的是( )
A.原子核外电子排布式:M为1s22s2,N为1s2
B.结构示意图:M![]() ,N
,N![]()
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
【答案】C
【解析】
A. M核外电子排布式为:1s22s2,则M为Be,N核外电子排布式为:1s2,则为He,不是同主族元素,故A错误;
B. 根据核电荷数可知M为Ne,N为Na+,不是同主族元素,故B错误;
C. M原子基态2p轨道上有一对成对电子,则其核外电子排布式为:1s22s22p4,为O元素,N原子基态3p轨道上有一对成对电子,则其核外电子排布式为:1s22s22p63s23p4,为S元素,二者为同主族元素,化学性质相似,故C正确;
D. M原子基态2p轨道上有1个未成对电子,M可能为B或F元素,N原子基态3p轨道上有1个未成对电子,N可能为Al或Cl元素,所以M和N可能不属于同一族,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】结合元素周期表,完成下列问题。
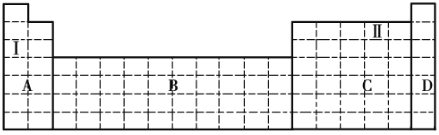
(1)在元素周期表中全部是金属元素的区域为____________(填序号)。
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为__________________,写出其中含有非极性共价键的化合物的电子式_______________。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①写出甲元素周期表中对应的位置__________。
②甲、乙两元素中,金属性较强的是__________(填元素名称),可以验证该结论的实验是_______________(填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是![]()
①稀豆浆、硅酸、氧化铁溶液都属于胶体
②纯碱、氨水、蔗糖分别属于强电解质、弱电解质和非电解质
③明矾、冰水混合物、四氧化三铁都不是混合物
④![]() 、MgO、
、MgO、![]() 均属于碱性氧化物
均属于碱性氧化物
⑤葡萄糖、油脂都不属于有机高分子
⑥电解熔融的![]() 可制得金属铝
可制得金属铝
A.①②B.②③C.③⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有0.1mol·L1的四种溶液:①CH3COOH②NH3·H2O③HCl④FeCl3
(1)用化学用语解释②呈碱性的原因:______。
(2)溶液③的pH=______。
(3)加热、蒸干、灼烧④后所得的产物是______。
(4)25℃时,向20mL①中不断滴入0.1mol·L1的NaOH溶液,混合溶液pH变化如图所示:
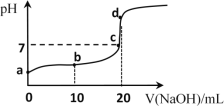
①a点水电离出的c(H+)______10-7mol·L1(填“大于”“小于”或“等于”)
②b点发生反应的离子方程式是______。
③c点溶液中存在的离子的浓度大小关系是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于溶液的下列说法不正确的是( )
A. 某温度下,Ba(OH)2溶液中Kw=10-12,向pH=8的该溶液中加入等体积pH=4的盐酸,充分反应后,混合溶液的pH=6
B. 水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-可能大量存在
C. 往0.1mol/LNH4Cl溶液中不断加入NaOH固体,随着NaOH的加入,![]() 不断减小
不断减小
D. 一定温度下,氢氧化钙达到溶解平衡,向此溶液中加入少量氧化钙粉末(不考虑热效应),则溶液中c(Ca2+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C===K2S+N2↑+3CO2↑。
(1)氮原子的价层电子排布图为___________,烟花燃放过程中,钾元素中的电子跃迁的方式是___________,K、S、N、O四种元素第一电离能由大到小的顺序为___________。上述反应涉及的元素中电负性最大的是___________(填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为![]() )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为___________,CO2分子的立体构型为___________。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______________________。
③CO分子中π键与σ键个数比为___________。
(3)超氧化钾的晶胞结构图如下:
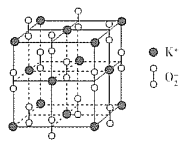
则与K+等距离且最近的K+个数为___________,若晶胞参数为dpm,则该超氧化物的密度为___________g·cm-3(用含d、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N和S是重要的非金属元素,聚氮化硫(SN)x是重要的超导材料,目前己成为全球材料行业研究的热点。回答下列问题:
(1)下列电子排布图能表示氮原子的最低能量状态的是_____(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.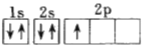
(2)S原子的基态原子核外有____个未成对电子,有__________种不同形状的电子云。
(3) S、N、O三种元素的第一电离能由大到小的顺序为________,列举一种与SCN-互为等电子体的分子为_______。
(4) (CH3)3N中N原子杂化方式为_______;As与N是同主族元素,AsH3的相对分子质量比NH3大,实验测得AsH3沸点比NH3低,其原因是___________。
(5) GaN是一种重要的半导体材料,其晶胞结构和金刚石类似,其晶胞结构如图。
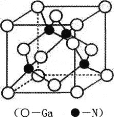
①氮化镓中氮原子与镓原子之间以_______键相结合,与同一个Ga原子相连的N原子构成的空间构型为_______。
②GaN晶体的晶胞边长为a pm,摩尔质量为M g/mol,阿伏加德罗常数的值为NA,则GaN晶体的密度为_______gcm-3 (只要求列算式,不必计算出结果,1pm=l0-12m)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,测得C的浓度为0.2mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,测得C的浓度为0.2mol·L-1。下列判断错误的是( )
A.x=1
B.B的转化率为40%
C.2min内A的反应速率为0.6mol·L-1·min-1
D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某NaOH试样中含有NaCl杂质,为测定试样中 NaOH 的质量分数,进行如下步骤实验:
① 称量 1.0g 样品溶于水,配成 250 mL 溶液;
② 准确量取 25.00 mL 所配溶液于锥形瓶中;
③ 滴加几滴酚酞溶液;
④ 用 0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答:
(1)称量1.0g 样品,除小烧杯、药匙外,所用到的主要仪器有_________。
(2)将样品配成 250 mL 溶液,除小烧杯、玻璃棒外,还需用到的玻璃仪器有_________。
(3)用_________滴定管(填“酸式”或“碱式”)盛装 0.10mol/L 的盐酸标准液。
(4)观察滴定到终点时溶液颜色的变化为_________。
(5)烧碱样品的纯度为_________。
(6)若出现下列情况,测定结果偏高的是_________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.盛装标准液的滴定管水洗后未用标准液再润洗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com