
【题目】T℃时,pH = 2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示

(1)图中a点的值为_________________
(2)若对上述硫酸再稀释10000倍则溶液中n (H+) :n(SO42-)=_______
(3)在T℃时,醋酸的电离平衡常数K=1.0×10-5, Kw=1.0×10-13则下列反应CH3COO-+H2O![]() CH3COOH+OH- 的平衡常数K=_____________。
CH3COOH+OH- 的平衡常数K=_____________。
(4)在T℃时,取pH=2的硫酸溶液0.5VmL稀释到2VmL ,与0.1mol/L的NaOH溶液0.15VmL混合后稀释至10VmL,溶液的pH=___________。
【答案】5200:11.0![]() 10-810
10-810
【解析】
对于硫酸来说,硫酸是二元强酸,在溶液中完全电离,电离方程式是:H2SO4=2H++SO42-,溶液的pH=2,c(H+)=2c(H2SO4)=10-2mol/L,当其稀释1000倍后,溶液中的c(H+)=10-5mol/L,溶液的pH=5;对于醋酸来说,是一元弱酸,在溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,主要以电解质分子存在,溶液的pH=2,从c(CH3COOH)> c(H+)=10-2mol/L;当其稀释1000倍后,已电离的氢离子浓度是原来的1/1000,由于溶液中存在电离平衡,未电离的醋酸分子会进一步电离出H+,所以溶液中的氢离子浓度大于原来的1/1000,则溶液的pH<5,据此分析。
CH3COO-+H+,主要以电解质分子存在,溶液的pH=2,从c(CH3COOH)> c(H+)=10-2mol/L;当其稀释1000倍后,已电离的氢离子浓度是原来的1/1000,由于溶液中存在电离平衡,未电离的醋酸分子会进一步电离出H+,所以溶液中的氢离子浓度大于原来的1/1000,则溶液的pH<5,据此分析。
(1)根据以上分析a=5,
因此,本题正确答案为:5;
(2)对于pH=2硫酸来说,c(H+)=2c(H2SO4)=10-2mol/L,c(SO42-)=![]() c(H+)=5×10-3mol/L,若对上述硫酸溶液稀释1000倍后,再稀释10000倍,则溶液几乎是中性溶液,c(H+)=10-7mol/L,c(SO42-)=5×10-3mol/L×10-3×10-4=5×10-10mol/L,则c (H+) :c(SO42-)=10-7mol/L: 5×10-10mol/L=200:1,由于溶液体积相等,所以二者的物质的量之比等于它们的物质的量浓度之比,故n (H+) :n(SO42-)=200:1,
c(H+)=5×10-3mol/L,若对上述硫酸溶液稀释1000倍后,再稀释10000倍,则溶液几乎是中性溶液,c(H+)=10-7mol/L,c(SO42-)=5×10-3mol/L×10-3×10-4=5×10-10mol/L,则c (H+) :c(SO42-)=10-7mol/L: 5×10-10mol/L=200:1,由于溶液体积相等,所以二者的物质的量之比等于它们的物质的量浓度之比,故n (H+) :n(SO42-)=200:1,
因此,本题正确答案为:200:1;
(3)在T℃时,醋酸的电离平衡常数K=1.0×10-5, Kw=1.0×10-13则下列反应CH3COO-+H2O![]() CH3COOH+OH- 的平衡常数K=
CH3COOH+OH- 的平衡常数K=![]() =
=![]() c(H+)c(OH-)=
c(H+)c(OH-)=![]() =1.0×10-8,
=1.0×10-8,
因此,本题正确答案为:1.0×10-8;
(4)在T℃时,取pH=2的硫酸溶液0.5VmL稀释到2VmL,体积是原来的4倍,浓度是原来的1/4,在开始时溶液的pH=2,c(H+)=10-2mol/L,则在0.5VmL该溶液中含有氢离子的物质的量是n(H+)=10-2mol/L×5V×10-4L=5V×10-6mol;0.1mol/L的NaOH溶液c(OH-)=0.1mol/L,当其体积是0.15VmL时其中含有氢氧根离子的物质的量是n(OH-)=0.1mol/L×0.15V×10-3L=1.5V×10-5mol,当二者混合时发生酸碱中和反应,根据酸碱中和反应的实质:H++OH-=H2O可知碱过量,则反应后的溶液的n(OH-)=1.5V×10-5mol-5V×10-6mol=1V×10-5mol,混合后溶液的体积是10VmL=10.5VmL=10-2VL,c(OH-)=![]() =10-3mol/L,在T℃时,Kw=1.0×10-13,则该溶液中c(H+)=
=10-3mol/L,在T℃时,Kw=1.0×10-13,则该溶液中c(H+)=![]() mol/L=10-10mol/L,所以pH=10,
mol/L=10-10mol/L,所以pH=10,
因此,本题正确答案为:10。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是
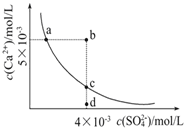
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
A. 2句 B. 3句 C. 4句 D. 5句
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是25 ℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=a,过滤结晶即可。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为__________________(填化学式)而除去。
(2)①中加入的试剂应该选择__________为宜,其原因是______________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为____________________________________。
(4)已知Fe(OH)3的Ksp=1×10-35 ;化学上通常认为残留在溶液中离子浓度小等于1×10-5mol/L时,沉淀完全。方案③中a最小值为________________。
(5)下列与方案③相关的叙述中,正确的是___________________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=a可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=a的溶液中
E.在pH>a的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置和相应试剂能达到实验目的的是( )
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 |
|
B | 制备纯净的NO | 浓硝酸 | Cu | 水 | |
C | 检验溶液X中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
D | 除去Na2SO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能比较氮和氧非金属性相对强弱的是
A.氨气在氧气中燃烧生成氮气B.沸点:H2O>NH3
C.NO中N为+2价,氧为-2价D.热稳定性:H2O>NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.带相反电荷离子之间的相互作用称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属元素原子间不可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按C、N、O、F的顺序,下列递变规律正确的是( )
A.原子半径逐渐增大
B.元素原子得电子能力逐渐减弱
C.气态氢化物稳定性逐渐增强
D.最高化合价逐渐增高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com