
| A. | 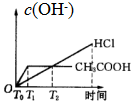 | B. | 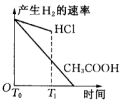 | C. |  | D. | 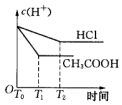 |
分析 n(Zn)=0.01mol,n(HCl)=0.01mol/L×0.1L=0.001mol,CH3COOH是弱电解质,醋酸浓度大于盐酸,所以等氢离子浓度、等体积的醋酸和盐酸,n(CH3COOH)>n(HCl)=0.001mol,酸和Zn反应离子方程式为Zn+2H+=Zn2++H2↑,根据方程式知,锌剩余,CH3COOH溶液中存在电离平衡,随着反应进行,CH3COOH又电离出H+进行反应,开始时c(H+)相同,开始的反应速率相同,反应过程中CH3COOH溶液中的c(H+)始终比HCl溶液中的c(H+)大,据此分析解答.
解答 解:n(Zn)=0.01mol,n(HCl)=0.01mol/L×0.1L=0.001mol,CH3COOH是弱电解质,醋酸浓度大于盐酸,所以等氢离子浓度、等体积的醋酸和盐酸,n(CH3COOH)>n(HCl)=0.001mol,酸和Zn反应离子方程式为Zn+2H+=Zn2++H2↑,根据方程式知,锌剩余0.0095mol,CH3COOH溶液中存在电离平衡,平衡状态下的H+不足,但随着反应进行,CH3COOH又电离出H+进行反应,放出的氢气一定比HCl多,开始时由于c(H+)相同,开始的反应速率相同,反应过程中CH3COOH溶液中的c(H+)始终比HCl溶液中的c(H+)大,所以反应速率快,故选C.
点评 本题考查弱电解质的电离,侧重考查分析、推断能力,明确弱电解质电离特点是解本题关键,注意反应速率与离子浓度有关,与电解质强弱无关,金属足量时产生气体的量与酸的量有关,与酸的强弱无关,这些都是易错点.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}{I}$的原子核内中子数多于质子数 | |
| B. | ${\;}_{53}^{131}{I}$的原子序数为131 | |
| C. | ${\;}_{53}^{131}{I}$的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}{I}$的化学性质与${\;}_{53}^{127}{I}$不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | M(MnSO4 固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 0 | 25 | |
| ③ | 1.0 | a | 4.0 | 0 | 25 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨中含有H2O,NH3•H2O,NH3,NH4+,NH2-等微粒 | |
| B. | 液氨中c(NH4+)•c(NH2-)是一个随温度升高而减小的常数 | |
| C. | 液氨的电离达到平衡时c(NH3)=c(NH4+)=c(NH2-) | |
| D. | 任何温度下,只要不加入其他物质,液氨中c(NH4+)和c(NH2-)一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入溴水中,观察溴水是否褪色 | |
| B. | 通入酸性高锰酸钾溶液中,观察颜色变化 | |
| C. | 点燃,检验燃烧产物 | |
| D. | 点燃,观察火焰明亮程度及产生黑烟量的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由 1 mol CuFeS2 生成 1mol Cu,共消耗 2.75 molO2 | |
| B. | 该冶炼方法中产生大量的有害气体SO2,可回收用于制备硫酸 | |
| C. | 在反应③中,Cu2S既是氧化剂,又是还原剂 | |
| D. | 在反应①中,SO2既是氧化产物,又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
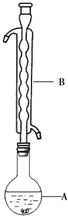 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.00 | 30.82 |
| 第二次 | 0.00 | 30.80 |
| 第三次 | 0.00 | 30.78 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com