
【题目】NaClO2 广泛用于造纸工业、污水处理等。工业上生产NaClO2 的工艺流程如下:
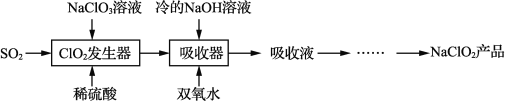
ClO2发生器中的反应为SO2 + 2NaClO3 + H2SO4 = 2ClO2↑+ 2NaHSO4
(1)NaClO3中Cl的化合价_______,上述反应中氧化剂是_______ ,被氧化的元素为_______。请用双线桥法表示该反应中电子转移的方向和数目SO2 + 2NaClO3 + H2SO4 = 2ClO2↑+ 2NaHSO4_______________________反应后,若产生0.6 mol气体,则电子转移的物质的量为 _______mol。
(2)吸收器中反应温度不能高于5℃的可能原因有 _______
(3)反应结束后,向ClO2发生器中通入一定量空气的目的是_______
【答案】+5 NaClO3 S 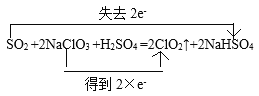 0.6 防止过氧化氢分解,提高ClO2的吸收率 赶出ClO2,确保其被充分吸收
0.6 防止过氧化氢分解,提高ClO2的吸收率 赶出ClO2,确保其被充分吸收
【解析】
(1)根据化合物中元素的化合价的代数和等于0分析元素化合价;根据氧化剂获得电子,被还原;还原剂失去电子,被氧化,得到氧化产物,元素化合价升降数目等于反应过程中电子转移数目;
(2)根据H2O2的稳定性与温度的关系分析;
(3)根据装置内含有ClO2的情况分析判断。
(1)在任何化合物中,所有元素化合价的化合价的代数和等于0,在NaClO3中Na是+1价,O是-2价,所以Cl元素的化合价为+5价;
在该反应中,Cl元素的化合价由反应前NaClO3中的+5价,变为反应后ClO2中的+4价,化合价降低,获得电子2×e-,所以NaClO3做氧化剂;S元素的化合价由反应前SO2中的+4价变为反应后NaHSO4中的+6价,化合价升高,失去电子2e-,SO2作还原剂,其中的S元素被氧化,用双线桥法表示电子转移为: ;
;
根据反应方程式可知:在该反应中每转移2mol电子,反应产生2molClO2 气体,若反应转移了0.6mol电子,则反应产生ClO2气体的物质的量是0.6mol;
(2)在反应过程中使用H2O2,该物质不稳定,温度高容易发生分解反应而变质,反应温度控制在5℃以内,就防止过氧化氢分解,从而提高ClO2的吸收率;
(3)反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其被充分吸收。


科目:高中化学 来源: 题型:
【题目】无论以何种比例混合的10mL混和气,在50mL的氧气中燃烧生成CO2和液态的H2O,燃烧后所得气体的体积为35mL,则该混合物可能为
A. C3H6 C4H6 B. C2H6 C3H6
C. C2H4 C3H8 D. C2H2 C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的的是
|
|
A、研究浓度对反应速率的影响 | B、研究阳离子对 |
|
|
C、研究沉淀的转化 | D、研究酸碱性对平衡移动的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是
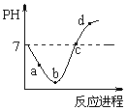
A. a点时,已经滴入NaOH溶液
B. b点所示的溶液中,只存在两种分子
C. a、b、c、d四个点中,c点水的电离程度最大
D. d点所示的溶液中,钠元素与氯元素的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换等方面应用广泛。
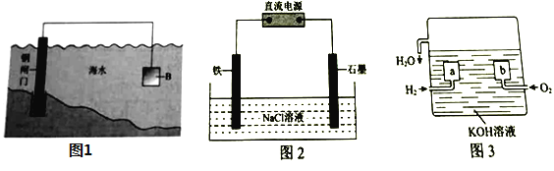
(1)①钢铁在海水中容易发生电化学腐蚀,负极反应式是____________。
②图1中,为减缓钢闸门的腐蚀,材料![]() 可以选择____________(填“
可以选择____________(填“![]() ”或“
”或“![]() ”)。
”)。
(2)图2为钢铁防护模拟实验装置,则铁做_________极,检测钢铁保护效果的方法是:取少量铁电极附近的溶液于试管中,___________,则说明保护效果好。
(3)氢氧燃料电池是一种新型的化学电源,其构造如图3所示:![]() 为多孔石墨电极,通入的气体由孔隙中逸出,并在电极表面放电。
为多孔石墨电极,通入的气体由孔隙中逸出,并在电极表面放电。
①![]() 的电极反应式是__________________;
的电极反应式是__________________;
②若电池共产生![]() 水,则电路中通过了___________
水,则电路中通过了___________![]() 的电子。
的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率可用于衡量电解质溶液导电能力的大小。向一定浓度的![]() 溶液中滴入某浓度的
溶液中滴入某浓度的![]() 溶液,其电导率随滴入的
溶液,其电导率随滴入的![]() 溶液体积的变化如图所示。下列说法不正确的是( )
溶液体积的变化如图所示。下列说法不正确的是( )
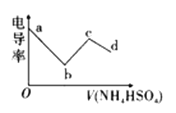
A. bc段的离子方程式为:![]()
B. c点溶液中:![]()
C. bc段之间存在某点,其溶液中:![]()
D. b点溶液存在三个平衡,且水的电离被抑制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的有( )
①需要通电才可以进行的有:电解、电离、电镀、电泳②水玻璃、福尔马林、天然橡胶、铝热剂都是混合物③![]() 、
、![]() 、
、![]() 均可由化合反应制得④油脂、淀粉、纤维素、天然橡胶都是天然有机高分子化合物⑤“血液透析”和“静电除尘”利用了胶体的同一种性质⑥
均可由化合反应制得④油脂、淀粉、纤维素、天然橡胶都是天然有机高分子化合物⑤“血液透析”和“静电除尘”利用了胶体的同一种性质⑥![]() 、
、![]() 分子中的碳原子均共面⑦铅蓄电池放电结束后,正极电极板的质量在减小
分子中的碳原子均共面⑦铅蓄电池放电结束后,正极电极板的质量在减小
A. 2个B. 3个C. 4个D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:已知亚磷酸![]() 是具有强还原性的二元弱酸,可被银离子氧化为磷酸。
是具有强还原性的二元弱酸,可被银离子氧化为磷酸。
(1)亚磷酸与银离子反应的离子方程式为_______________________。
(2)向亚磷酸溶液中滴加氢氧化钠溶液至中性,写出所得溶液中电荷守恒方程式_________________。
(3)某温度下,![]() 的亚磷酸溶液的pH为1.4,即
的亚磷酸溶液的pH为1.4,即![]() ,则该温度下亚磷酸的一级电离平衡常数
,则该温度下亚磷酸的一级电离平衡常数![]() _________。(亚磷酸第二级电离忽略不计,结果保留两位有效数字)
_________。(亚磷酸第二级电离忽略不计,结果保留两位有效数字)
Ⅱ:焦亚硫酸钠![]() 在医药、印染、食品等方面应用广泛,也可作为食品的抗氧化剂。
在医药、印染、食品等方面应用广泛,也可作为食品的抗氧化剂。
(4)工业上制备焦亚硫酸钠![]() 常用
常用![]() 与碳酸钠溶液的反应,当
与碳酸钠溶液的反应,当![]() 加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,写出该反应的化学方程式:__________________________。
加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,写出该反应的化学方程式:__________________________。
(5)由于![]() 具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中
具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中![]() 的残留量时,取40mL葡萄酒样品,用
的残留量时,取40mL葡萄酒样品,用![]() 的含有淀粉的碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为_________________,该样品中
的含有淀粉的碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为_________________,该样品中![]() 的残留量为___________
的残留量为___________ ![]() (以
(以![]() 计)。
计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A. 图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com