
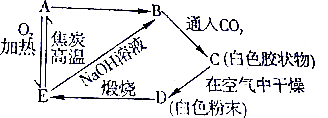
分析 A能和氧气在加热条件下反应生成E,E中含有氧元素,E能和NaOH反应生成B,B为可溶性钠盐,B通入二氧化碳生成白色胶状物,C在空气中干燥得到白色粉末,煅烧D得到E,E能和焦炭反应生成A,则A为Si、E为SiO2、B为Na2SiO3、C为H4SiO4、D为H2SiO3,据此分析解答.
解答 解:A能和氧气在加热条件下反应生成E,E中含有氧元素,E能和NaOH反应生成B,B为可溶性钠盐,B通入二氧化碳生成白色胶状物,C在空气中干燥得到白色粉末,煅烧D得到E,E能和焦炭反应生成A,则A为Si、E为SiO2、B为Na2SiO3、C为H4SiO4、D为H2SiO3,涉及的反应方程式为Si+O2$\frac{\underline{\;\;△\;\;}}{\;}$SiO2、SiO2+2C$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si、SiO2+2NaOH=Na2SiO3+H2O、H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+SiO2、Na2SiO3+CO2+2H2O=H4SiO4+Na2CO3、2Si+2NaOH+2H2O=Na2SiO3+3H2↑,
故答案为:Si;Na2SiO3;H4SiO4;H2SiO3;SiO2.
点评 本题以Si及其化合物为载体考查无机物推断,为高频考点,明确物质性质及物质之间转化是解本题关键,注意:高温条件下二氧化硅和C反应生成CO而不是二氧化碳,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | Mg+2H2O$\frac{\underline{\;△\;}}{\;}$Mg(OH)2+H2↑ | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2K+2H2O═2KOH+H2↑ | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 | |
| B. | 根据反应过程中是否有氧原子的得失,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据化合物在水溶液或熔融状态是否能导电,将化合物分为电解质和非电解质 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
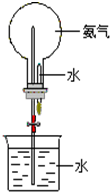 已知氨气与氯化氢气体都是极易溶于水的气体,在标准状况下1升水中最多能溶解500升的氯化氢气体,或者700升的氨气.
已知氨气与氯化氢气体都是极易溶于水的气体,在标准状况下1升水中最多能溶解500升的氯化氢气体,或者700升的氨气.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com