
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )
A.原溶液一定存在CO32﹣和SO42﹣ , 一定不存在Fe3+
B.原溶液一定存在Cl﹣ , 可能存在Na+
C.原溶液中c(Cl﹣)≥0.1molL﹣1
D.若原溶液中不存在Na+ , 则c(Cl﹣)<0.1molL﹣1
【答案】D
【解析】解:加入氯化钡溶液,生成沉淀,一定含有碳酸根或是硫酸根中的至少一种,则该沉淀为BaSO4、BaCO3中的至少一种,沉淀部分溶解于盐酸,所以一定是BaSO4、BaCO3的混合物,一定存在CO32﹣、SO42﹣,硫酸钡沉淀是2.33g,物质的量是 ![]() =0.01mol,碳酸根离子的物质的量是
=0.01mol,碳酸根离子的物质的量是 ![]() mol=0.01mol,碳酸根和铁离子不共存,一定不存在Fe3+,所得到的滤液中加入氢氧化钠,出现气体,为氨气,一定含有铵根离子,根据元素守恒,铵根离子的物质的量是
mol=0.01mol,碳酸根和铁离子不共存,一定不存在Fe3+,所得到的滤液中加入氢氧化钠,出现气体,为氨气,一定含有铵根离子,根据元素守恒,铵根离子的物质的量是 ![]() =0.05mol,根据电荷守恒,阳离子所带正电荷的物质的量之和:0.05mol,阴离子所带负电荷的物质的量之和=0.01×2+0.01×2=0.04mol,所以一定存在氯离子,钠离子不能确定,n(Cl﹣)≥0.01mol,所以c(Cl﹣)≥0.1molL﹣1.
=0.05mol,根据电荷守恒,阳离子所带正电荷的物质的量之和:0.05mol,阴离子所带负电荷的物质的量之和=0.01×2+0.01×2=0.04mol,所以一定存在氯离子,钠离子不能确定,n(Cl﹣)≥0.01mol,所以c(Cl﹣)≥0.1molL﹣1.
A、原溶液一定存在CO32﹣和SO42﹣、Cl﹣,一定不存在Fe3+,A不符合题意;
B、原溶液一定存在Cl﹣,可能存在Na+,B不符合题意;
C、原溶液中c(Cl﹣)≥0.1molL﹣,C不符合题意;
D、若原溶液中不存在Na+,则c(Cl﹣)=0.1molL﹣1,D符合题意.
所以答案是:D.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( ) 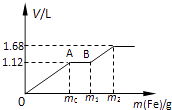
A.开始时产生的气体为H2
B.AB段发生的反应为置换反应
C.所用混合溶液中c(HNO3)=0.5 molL﹣1
D.参加反应铁粉的总质量m2=5.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( ) 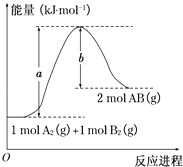
A.每生成2分子AB吸收b kJ热量
B.该反应热△H=+(a﹣b)kJmol﹣1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A﹣A和1 mol B﹣B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在工业生产和日常生活中有重要用途.
(1)工业上用钛铁矿石(FeTiO3 , 含FeO、Al2O3、SiO2等杂质)经过下述反应制得: 
其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.
(i)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式: .
(ii)④中加入的X可能是
(iii)④⑤两步的目的是 .
(iv)写出⑥的化学反应方程式 .
(2)TiO2可通过下述两种方法制备金属钛:方法一是先将TiO2与Cl2、C反应得到TiCl4 , 再用镁还原得到Ti.
(i)写出生成TiCl4的化学反应方程式
方法二是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.
(ii)阴极反应的电极反应式为 .
(iii)电解过程中需定期向电解槽池中加入碳块的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们会利用纳米级(1-100nm,1nm=10-9m)微粒物质制造出更加优秀的材料和器件,使化学在材料、能源、环境和生命科学等领域发挥越来越重要的作用。将纳米级微粒物质溶解于液体溶剂中形成一种分散系,对该分散系及分散质颗粒的叙述中正确的是( )
A. 该分散系能发生丁达尔效应 B. 该分散系为溶液
C. 该分散系属于悬浊液 D. 该分散系放置一段时间可能很快出现分层现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 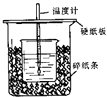
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NCl3可用于漂白,也可用于柠檬等水果的熏蒸处理.已知:NCl3熔点为﹣40℃,沸点为70℃,95℃以上易爆炸,有刺激性气味,可与水反应.实验室中可用氯气和氨气反应制取NCl3 , 反应方程式为4NH3+3C12 ![]() NCl3+3NH4Cl.某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右).
NCl3+3NH4Cl.某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右).
回答下列问题:
(1)写出装置F中的烧瓶内发生反应的离子方程式: . 写出A装置中的试管内发生的反应的化学方程式:
(2)E中的试剂为;B中的试剂为
(3)导管G末端应连接的装置为图中的(填选项字母). 
(4)NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,另一种有强氧化性,可使有色物质褪色.写出NCl3水解的化学方程式: .
(5)已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气是一种低热值煤气,主要成分为H2和CO,主要作为工业上合成氨和液体燃料的原料.
(1)反应CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41KJ/mol的v﹣t图象如图1所示,若其他条件不变,只是在反应前缩小体积使压强增大,则其v﹣t图象如图2所示. 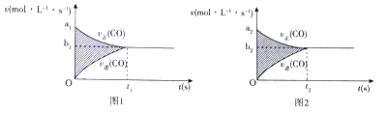
下列说法正确的是
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图2阴影部分面积更大
A.①④⑤⑦
B.①③⑥⑦
C.②④⑤⑧
D.②④⑤⑦
(2)在一定温度下将C单质和CO2(g)各0.10mol充入体积为1L的恒容密闭容器中发生反应C(s)+CO2(g)2CO(g)△H=+172KJ/mol.
①下列示意图正确且能说明反应在t1时刻已经达到化学平衡状态的是(填序号).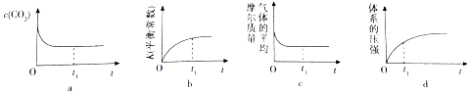
②达到平衡时,容器内的压强为起始时的1.5倍,则此时反应的化学平衡常数K=;若此时再分别加入0.05mol的CO2和0.1mol的CO,则此时平衡将(填“左移”、“右移”或“不移动”.)若将该反应的起始条件改为恒温恒压,则达到平衡时,CO2的转化率将(填“增大”“减小”或“不变”).
(3)工业上用焦炭和水蒸气制备水煤气的热化学方程式为
(4)在一定条件下以CO和H2为原料可以合成乙醇,反应方程式为:2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)△H=aKJ/mol.
请从反应能否自发进行的角度解释a一定小于0的原因: , 若只改变反应的一个条件,能使平衡体系中n ![]() 增大的措施有(答出两点即可)
增大的措施有(答出两点即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com