
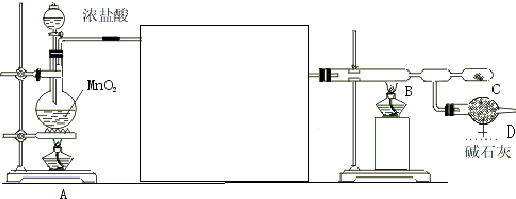
分析 根据实验装置,A中用浓盐酸与二氧化锰反应生成氯气,制得的氯气中常有氯化氢和水蒸气杂质,经过除氯化氢和干燥后的氯气在B装置中与铝反应生成氯化铝,氯化铝易水解,要防止空气中的水蒸气进入,同时氯气有毒,不能排放到空气中,所以用c装置装碱石灰进行吸收和干燥,
(1)根据装置图可写出仪器名称,根据浓盐酸和二氧化锰的性质判断生成物,从而确定方程式;
(2)反应制得的氯气中有氯化氢和水,铝与氯化氢会产生氢气,无水氯化铝露置于潮湿空气中会爆炸并产生大量白雾,所以制取的氯气必须干燥除杂;
(3)为了制取纯净的无水氯化铝,需排净装置中的空气,点燃A酒精灯用产生的氯气来排净空气后再点燃B酒精灯开始反应制取无水氯化铝;
(4)氯化铝易升华,生成的氯化铝气体会聚集在C处;
(5)装置D既可以吸收多余的氯气,防止污染环境,又可以防止空气中的水蒸气进入D中.
解答 解:(1)根据装置图可知,仪器名称a为分液漏斗,浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2 ↑+2H2O,
故答案为:分液漏斗;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2 ↑+2H2O;
(2)浓盐酸具有挥发性,所以混合气体中含有氯化氢,选用饱和食盐水吸收氯化氢气体,无水氯化铝露置于潮湿空气中会爆炸并产生大量白雾,所以制取的氯气必须干燥,故选取浓硫酸干燥,应将A中产生的气体依次通过饱和食盐水和浓硫酸的装置,
故答案为:饱和食盐水和浓硫酸的装置;
(3)为了制取纯净的无水氯化铝,需排净装置中的空气,点燃A酒精灯用产生的氯气来排净空气后再点燃B酒精灯开始反应制取无水氯化铝,
故答案为:A;
(4)氯化铝在178℃升华,产物以气体形式存在,主要聚集在C处,故可以在C收集到纯净的氯化铝,
故答案为:AlCl3易升华;
(5)反应有多余的氯气需要用碱性物质吸收,还要防止空气中的水蒸气进入装置,故在D装置中加碱石灰,
故答案为:吸收多余的Cl2且防止水蒸气进入C使AlCl3发生水解.
点评 本题通过氯化铝的制取,考查了氯气的制备和性质的检验,熟悉反应原理是解题关键,题目难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 加热晶体时先用小火,后渐改为用大火加热至晶体变白 | |
| B. | 灼烧时如有晶体溅出容器,应再加一些晶体继续加热 | |
| C. | 加热后的冷却放在干燥器中进行 | |
| D. | 加热、冷却、称量,重复多次即是恒重操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/(g/cm3) | 溶解性 |
| 甲醇 | 64.7 | - | 0.795 | 易溶于水 |
| 乙醚 | 34.5 | - | 0.7138 | 难溶于水 |
| 3,5-二甲氧基苯酚 | 172 | 36 | - | 易溶于甲醇、乙醚、微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
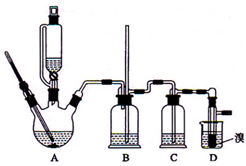 实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应:CH2=CH2+Br2→BrCH2CH2Br.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:
实验室制备1,2-二溴乙烷的反应原理是先用乙醇制备出乙烯,再将乙烯通入溴水中发生如下反应:CH2=CH2+Br2→BrCH2CH2Br.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
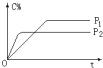 可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )
可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )| A. | P1>P2,n>3 | B. | P1>P2,n<3 | C. | P1<P2,n<3 | D. | P1<P2,n>3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com