
(14分)I.如下图所示,50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在装置中进行中
和反应。通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:

(1)图中装置缺少的仪器是 。
(2)下列说法不正确的是 (填序号)。
A.若用50mL0.55mol·L-1Ba(OH)2溶液代替NaOH溶液进行实验,测得的中和热相同
B.若用50mL0.50mol·L-1醋酸溶液代替盐酸进行实验,测得的中和热相同
C.若分别用等浓度的硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行实验,测得的中和热相同
D.NaOH溶液稍过量的原因是让盐酸完全反应
II.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B.用标准溶液润洗滴定管2-3次
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)实验中眼睛注视_______________,直至滴定终点。判断到达终点的现象是__________________。
(3)若三次实验所用KOH溶液体积分别为14.98 mL,16.80 mL,15.02 mL则c(HCl)= 。
(4)下列操作中,可能造成测定结果偏高的是 。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管中液面刻度,其它操作均正确
C.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
I.(1)环形玻璃搅拌棒 (2)BC II.(1)BDCEAF 或ABDCEF (2)锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。 (3)0.075mol/L (4)AD
【解析】
试题解析:I.(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;(2)醋酸是弱电解质,电离要吸热,测得的中和热数据会偏小,故B应选;硫酸雨氢氧化钡反应,除生成水外还生成硫酸钡,放出热量增多,使中和热数据偏大,故C应选;II.(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为BDCEAF;(2)滴定时,滴定过程中,用左手控制碱式滴定管橡皮管玻璃珠处,右手摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化;滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;(3)16.80 mL与其它数据差别过大,舍去,则V(NaOH)(平均消耗)==1/2(14.98 +15.02)mL=15.00mL,c(HCl)=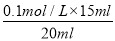 =0.075mol/L;(4)未用标准液润洗碱式滴定管,标准液碱的浓度偏小,造成V(碱)偏高,根据c(酸)=
=0.075mol/L;(4)未用标准液润洗碱式滴定管,标准液碱的浓度偏小,造成V(碱)偏高,根据c(酸)=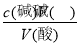 ,可知c(酸)偏高,故A正确;滴定终点读数时,俯视滴定管的刻度,V(碱)偏小,根据c(酸)=
,可知c(酸)偏高,故A正确;滴定终点读数时,俯视滴定管的刻度,V(碱)偏小,根据c(酸)=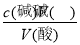 ,可知c(酸)偏小,故B错误;盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,则V(碱)不变,根据c(酸)=
,可知c(酸)偏小,故B错误;盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,则V(碱)不变,根据c(酸)=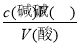 ,可知c(酸)不变,故C错误;滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(碱)偏高,根据c(酸)=
,可知c(酸)不变,故C错误;滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(碱)偏高,根据c(酸)=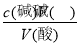 ,可知c(酸)偏高,故D正确。
,可知c(酸)偏高,故D正确。
考点:酸碱中和滴定


科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列溶液中,物质的量浓度最大的是
A.1 L H2SO4溶液中含98 g H2SO4 B.0.5 L含49 g H2SO4的溶液
C.98 g H2SO4溶于水配成2 L溶液 D.0.1 L含24.5 g H2SO4的溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高一上期中考试化学试卷(解析版) 题型:实验题
(10分)下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。
现欲用该浓硫酸配制成1mol/L的稀硫酸。

现实验室仅需要这种稀硫酸220mL.试回答下列问题:
(1)用量筒量取该浓硫酸 mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是 。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是 。
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中。
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与
刻度线相切
E.容量瓶不干燥
F.定容时,俯视容量瓶刻度线
(4)下列操作中,容量瓶所不具备的功能有 。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(5)某同学用固体 配制500ml 0.1mol·L-1
配制500ml 0.1mol·L-1  溶液的过程如下图所示:
溶液的过程如下图所示:


你认为该同学的错误步骤有 。
A.1处 B.2处 C.3处 D.4处
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高一上期中考试化学试卷(解析版) 题型:选择题
盐是一类常见物质,下列物质可直接和适当的物质反应生成盐的是
①金属 ②碱性氧化物 ③碱 ④非金属 ⑤酸性氧化物 ⑥酸
A.只有①②③ B.只有①④⑥ C.只有②⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015学年贵州省高二上学期半期考试化学试卷(解析版) 题型:选择题
在2A+B?3C+4D反应中,表示该反应速率最快的是( )
①单位时间内生成a mo1 O2的同时生成2a mol NO2
②单位时间内生成a mol O2的同时生成2a molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③④ B.②④⑤ C.①③⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第一次月考化学试卷(解析版) 题型:填空题
(15分)(1)从NaCl、CuSO4两种电解质中选取适当的物质,按电解要求填写(填化学式):
①以铜为电极,进行电解时电解质浓度不变,则采用的电解质是__________。
②以碳棒为电极,进行电解时使电解质和水的质量均变小,则采用的电解质是________。
此电解反应的阳极反应式: ,电解池的总反应化学方程式: 。
(2)①甲同学用直流电源、碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)===CuSO4+H2↑,则该同学选用的阳极材料是_______。
②乙同学在做铜与稀硫酸的上述反应实验时,看到碳棒和铜棒上都有气泡产生,但铜棒却没有被腐蚀。请你选出最可能的原因 (填字母代号)
A.铜被稀硫酸钝化 B.碳棒和铜棒与电源正负极接反
此时的电解池的总反应为____________ ____________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第一次月考化学试卷(解析版) 题型:计算题
(9分)超氧化钾(KO2)能与水发生如下反应:4KO2+2H2O=4KOH+3O2↑。将14.2g超氧化钾投入足量水中,超氧化钾全部溶解。计算:
(1)反应生成的O2在标准状况下的体积;
(2)反应生成的K+个数;
(3)向反应后的溶液中加入足量的稀硫酸后,溶液中存在的K+个数。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列图示中正确的实验操作是
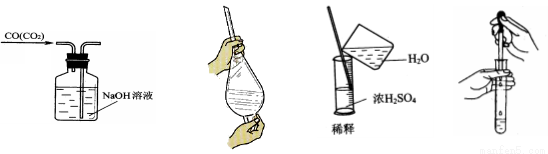
A.除去CO的CO2 B.萃取时振荡混合液
C.稀释浓硫酸 D.向试管中滴加液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com