
| A. | 3和9 | B. | 6和8 | C. | 13和17 | D. | 15和17 |
分析 原子序数分别为3、6、8、9、13、15、17的元素对应为:Li、C、O、F、Al、P、Cl,结合元素可以形成化合物判断.
解答 解:A.3号元素是Li,9号元素是F元素,二者形成LiF,不符合XY3,故A错误;
B.6号元素是C,8号元素是O,可以形成CO、CO2,不符合XY3,故B错误;
C.13号元素是Al,17号元素是Cl元素,二者组成AlCl3,符合XY3,故C正确;
C.15号元素是P,17号元素是Cl元素,二者可以组成PCl3,符合XY3,故D正确.
故选CD.
点评 本题考查原子结构与元素性质,难度不大,注意利用验证法进行解答,熟练掌握常见元素化合物组成,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
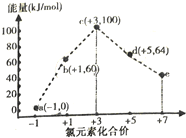
| A. | e是ClO3- | |
| B. | b→a+c反应的活化能为60kJ•mol-1 | |
| C. | a,b,c,d,e中c最稳定 | |
| D. | b→a+d反应的热化学方程式为3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-116kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +H2O→RCOOH+R′COOH
+H2O→RCOOH+R′COOH 中的官能团名称为醛基、羟基
中的官能团名称为醛基、羟基 ,DCH3COOH,G
,DCH3COOH,G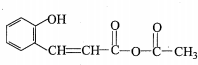

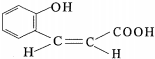
 氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式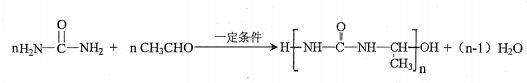
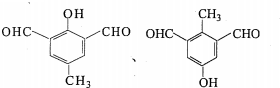 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃时,1LpH=1.0的H2SO4溶液中含H+为0.1NA | |
| B. | 常温下,14g的146C含中子数目为6NA | |
| C. | 标况下,11.2LNO与11.2LO2混合,原子总数小于2NA | |
| D. | 0.1mol苯乙烯含碳碳双键为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

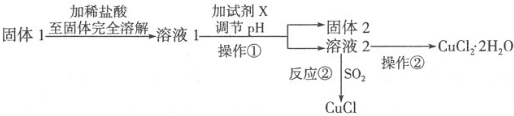
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;D在元素周期表中的位置为第三周期ⅢA族.
;D在元素周期表中的位置为第三周期ⅢA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaOH溶液产生红褐色沉淀,则原溶液中一定有FeCl3 | |
| B. | 加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定是CO32-或SO32- | |
| C. | 先通入少量Cl2后,再加入淀粉溶液后,溶液变蓝,说明有I- | |
| D. | 往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明一定有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com