
| c(Cl-) |
| c(ClO-) |
A����ij�¶��£���Ӧ��
| ||||||
B���μӷ�Ӧ�����������ʵ�������
| ||||||
C���ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���ne�ķ�Χ��
| ||||||
D���ı��¶ȣ�������KClO3��������۲���Ϊ
|
| c(Cl-) |
| c(ClO-) |
| c(Cl-) |
| c(ClO-) |
| c(ClO-) |
| c(ClO3-) |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 6 |
| 1 |
| 6 |
| 1 |
| 6 |
| 5 |
| 6 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 5 |
| 6 |
| 1 |
| 6 |
| 1 |
| 6 |


 �����ߴ���ϵ�д�
�����ߴ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
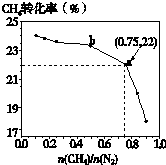 ��֪��3CH4��g��+2N2��g��
��֪��3CH4��g��+2N2��g��| 700�� |
| ���� |
| n(CH4) |
| n(N2) |
A��
| ||
B��
| ||
| C��b���Ӧ��ƽ�ⳣ����a��Ĵ� | ||
| D��a���Ӧ��NH3���������ԼΪ26% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������Al3+��Ҳ������Mg2+ |
| B��ֻ����Al3+ |
| C��ֻ����Mg2+ |
| D������˵�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
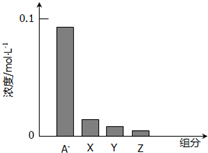 �����£�0.2mol/L��һԪ��HA���Ũ�ȵ�NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ���ǣ�������
�����£�0.2mol/L��һԪ��HA���Ũ�ȵ�NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ���ǣ�������| A��HAΪǿ�� |
| B���û��ҺpH=7 |
| C��ͼ��X��ʾHA��Y��ʾOH-��Z��ʾH+ |
| D���û����Һ�У�c��A-��+c��Y��=c��Na+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
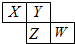 ��ͼ��ʾ��Ԫ�����ڱ���һ���֣�X��Y��Z��W��Ϊ������Ԫ�أ���wԭ�����������������ڲ��������
��ͼ��ʾ��Ԫ�����ڱ���һ���֣�X��Y��Z��W��Ϊ������Ԫ�أ���wԭ�����������������ڲ��������| 7 |
| 10 |
| A��XY2��ZY2��������������Ҫ���� |
| B��YԪ�ص�����ͬ���������ڳ����¶������� |
| C������������Ӧˮ���������W��Z |
| D���⻯��ķе㣺HnZ ����HnY |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com