
| A. | 浓度均为0.1mol/L的①CH3COOH ②NH4Cl ③H2SO4三种溶液中,由水电离出的c(H+):①>③>② | |
| B. | 常温下,pH=2与pH=3的CH3COOH溶液,前者的c(CH3COOH)是后者的10倍 | |
| C. | 任意稀盐酸中c(H+)的精确计算式可以表示为c(H+)=c(Cl-)+Kw/c(OH-) | |
| D. | 同c(NH4+)的溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4溶液,物质的量浓度最大的是③ |
分析 A.酸或碱抑制水电离,且酸中氢离子浓度越大其抑制水电离程度越大,含有弱离子的盐促进水电离;
B.相同温度下,同一弱电解质溶液的浓度越大其电离程度越小;
C.盐酸溶液中c(H+)为HCl与水电离c(H+)之和,稀盐酸溶液无论浓度大小均为酸性溶液,由水电离的c(H+)等于溶液中c(OH-),溶液中c(OH-)为$\frac{{K}_{w}}{c({H}^{+})}$;
D.Al3+和NH4+相互抑制水解,CH3COO-促进NH4+水解,氯离子对NH4+水解无影响,一水合氨是弱碱存在微弱的电离平衡,①②④是强电解质,在水溶液中完全电离,③是弱电解质,在水溶液中部分电离,相同浓度的这几种溶液中一水合氨中c(NH4+)浓度最小.
解答 解:A.酸或碱抑制水电离,且酸中氢离子浓度越大其抑制水电离程度越大,含有弱离子的盐促进水电离,所以①③抑制水电离,但①抑制水电离程度小于③,③促进水电离,所以由水电离出的c(H+):②>①>③,故A错误;
B.相同温度下,同一弱电解质溶液的浓度越大其电离程度越小,所以pH=2的醋酸电离程度小于pH=3的醋酸,所以前者的c(CH3COOH)大于后者的10倍,故B错误;
C.盐酸溶液中c(H+)为HCl与水电离c(H+)之和,稀盐酸溶液无论浓度大小均为酸性溶液,由水电离的c(H+)等于溶液中c(OH-),溶液中c(OH-)为$\frac{{K}_{w}}{c({H}^{+})}$,所以存在c(H+)=c(Cl-)+$\frac{{K}_{w}}{c({H}^{+})}$,故C错误;
D.Al3+和NH4+相互抑制水解,CH3COO-促进NH4+水解,氯离子对NH4+水解无影响,一水合氨是弱碱存在微弱的电离平衡,①②④是强电解质,在水溶液中完全电离,③是弱电解质,在水溶液中部分电离,相同浓度的这几种溶液中一水合氨中c(NH4+)最小,所以c(NH4+)的溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4溶液,物质的量浓度最大的是③,故D正确;
故选D.
点评 本题考查弱电解质的电离和盐类水解,为高频考点,侧重考查学生分析比较判断能力,明确水电离影响因素、弱电解质浓度与其电离程度关系是解本题关键,易错选项是C,D采用逆向思维方法分析解答,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中,水的电离程度:①>② | |
| B. | 分别中和等体积相同物质的量浓度的NaOH溶液,则消耗溶液的体积:①<② | |
| C. | 等体积的①、②溶液分别与足量铝粉反应,生成H2的质量:①=② | |
| D. | 将等体积的①、②溶液中分别稀释10倍后,溶液的pH:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离平衡常数(K)越小,表示弱电解质电离能力越弱 | |
| B. | BaSO4难溶于水,但它是强电解质,氨水是弱电解质 | |
| C. | 强电解质是离子化合物,弱电解质是共价化合物 | |
| D. | 氨气溶于水,当c(OH-)=c(NH4+)时,表明氨水电离处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
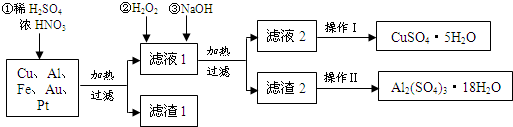

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
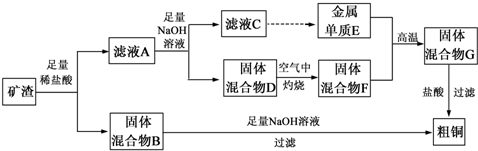
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
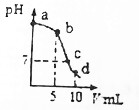 25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )
25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Cl-、Mg2+、NO3- | B. | K+、Cl-、Mg2+、SO42- | ||
| C. | Fe3+、Na+、NO3-、Al3+ | D. | HCO3-、NH4+、Ag+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com