
【题目】2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,充放电时AlCl4—和Al2Cl7—两种离子在Al电极上相互转化,其它离子不参与电极反应,其放电工作原理如右图所示。下列说法正确的是

A. 放电时,有机阳离子向铝电极方向移动
B. 充电时,外加电源时铝连正极、石墨连负极
C. 放电时负极的电极反应为:4![]() =Al-3e-+7
=Al-3e-+7![]()
D. 该电池的工作原理为:Al+4![]() +3CnAlCl4
+3CnAlCl4  3Cn+4
3Cn+4![]()
【答案】D
【解析】A、放电时,活泼的金属铝是负极,不活泼石墨为正极,放电时,有机阳离子向正极石墨电极方向移动,故A错误;B、充电时,铝电极是阴极连接外加电源的负极,石墨电极是阳极连接外加电源的正极,故B错误;C、放电时,活泼的金属铝是负极,电极反应为:Al-3e-+7AlCl4-=4Al2Cl7-,故C错误;D、放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-═4Al2Cl7-,正极上电极反应式为:CnAlCl4+e-═Cn+AlCl4-,两极反应相加得到总反应:3CnAlCl4+Al+4AlCl4-  4Al2Cl7-+3Cn,故D正确;故选D。
4Al2Cl7-+3Cn,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

A. a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH![]() )
)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见下表。
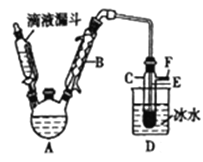
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)制备操作中,加入的浓硫酸必须进行稀释,其目的是_____(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(2)己知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式:________________。
(3)仪器B的名称是________,冷却水应从B的____(填“上“或“下")口流进。
(4)反应生成的溴乙烷应在______(填“A"或"C")中。
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列_____(填字母)溶液来洗涤产品。
a氢氧化钠 b.碘化亚铁 c.亚硫酸钠 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0。下列判断正确的是 ( )
2SO3(g)ΔH<0。下列判断正确的是 ( )
A. 增大反应体系的压强,平衡后SO2的浓度、转化率、体积分数都增加
B. 当单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,反应达到平衡状态
C. 升高温度,平衡向左移动
D. 充入SO3气体,体系压强增大,平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列电解质溶液,有关叙述正确的是( )
A. 等物质的量浓度的NaCl和AlCl3混合液完全电解后,所得的混合液的pH值增大
B. NaCl溶液电解一定时间后,要恢复到电解前状态,应加入适量盐酸
C. Na2SO4溶液在电解过程中,阴极区pH值降低
D. 电解CuSO4溶液,阳极反应式为:2H2O+O2+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度变化如图所示。据图分析,下列判断正确的是

A. [Ksp[Cu(OH)2]<Ksp[Fe(OH)3]
B. d点代表的溶液中Fe(OH)3已过饱和、Cu(OH)2未饱和
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. b、c两点代表的Fe(OH)3、Cu(OH)2溶解度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究一氧化氮、二氧化氮、硝酸之间的相互转化,有同学设计了如下实验:如图将少量铜片装入小试管中,再加人适量稀硝酸,然后迅速将大试管倒扣在小试管外。将套好的大、小试管一起竖立在烧杯中,使水浸没大试管口。充分反应完后,通过弯玻璃管往大试管中吹人足量空气,并往烧杯中滴人几滴紫色石蕊试液。试回答:
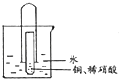
(1)写出铜片溶于稀硝酸的离子方程式________。
(2)吹入空气前小试管中的现象是铜片逐渐溶解.溶液变蓝色及________。
(3)假设小试管中加入了 0.192g铜片和5ml浓度为2mol/L的稀硝酸,则充分反应后小试管内溶 液中NO ![]() 物质的量浓度为________mol/L(忽略溶液体积变化)。
物质的量浓度为________mol/L(忽略溶液体积变化)。
(4)若将水换成氢氧化钠溶液,实验过程中生成的一种红棕色气体会与它发生反应,生成两种钠盐和水,且氧化产物与还原产物的物质的量相等,试写出该反应的离子方程式________。
(5)将等质里的铜片分别与等体积过量的浓、稀硝酸反应(假设溶液体积不变 所得溶液前者呈绿色,后者呈蓝色。某同学认为可能是Cu2+浓度的差异引起的,你认为是否正确?________(填“正确”或“不正确”),理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 用托盘天平直接称量烧碱4.0g
B. 在蒸发皿中灼烧CuSO4·5H2O晶体以除去结晶水
C. 用标准盐酸溶液滴定未知浓度的氨水,用酚酞作指示剂
D. 配制0.9%的氯化钠溶液时,将称量的氯化钠放入烧杯中加计量的水搅拌溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com