
| A. | 摩尔是国际单位制七个基本物理量之一 | |
| B. | 1 L 0.1 mol/L BaCl2溶液中所含的Cl-为0.1 NA | |
| C. | 常温常压下,11.2 L Cl2所含的分子数为0.5 NA | |
| D. | 常温常压下,32 g O2含有的氧原子数为2 NA |
分析 A.摩尔是物质的量的单位;
B.依据n=CV计算氯化钡物质的量,1mol氯化钡含有2mol氯离子;
C.常温常压下,Vm大于22.4L/mol;
D.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算.
解答 解:A.摩尔是物质的量的单位,物质的量是国际单位制七个基本物理量之一,故A错误;
B.1 L 0.1 mol/L BaCl2溶液中含有氯化钡物质的量为1L×0.1mol/L=0.1mol,所含的Cl-为0.2 NA,故B错误;
C.常温常压下,Vm大于22.4L/mol,11.2 L Cl2所含的分子数为小于0.5 NA,故C错误;
D.常温常压下,32 g O2含有的氧原子数为$\frac{32g}{32g/mol}$×2×NA=2 NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:多选题
| A. | NaHB的存在抑制了水的电离 | |
| B. | HB-水解方程式:HB-+H2O?H3O++B2- | |
| C. | 相同物质的量浓度溶液的pH值:NaHB>Na2B | |
| D. | 溶液中离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| C. | 利用纳米铁粉的物理吸附作用去除水体中的Gu2+、Hg2+等重金属离子 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g由O2和O3的混合气体中含有的分子数为0.5NA | |
| B. | 2.3g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA | |
| C. | 100mL 12mol/L浓盐酸与足量MnO2共热,生成的Cl2分子数为0.3NA | |
| D. | 标准状况下,22.4LSO3含有的分子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 其他条件不变,0.01mol•L-1的酸性KMnO4溶液分别与0.1mol•L-1的H2C2O4溶液和0.2mol•L-1的H2C2O4溶液反应,后者褪色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
| B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
| C | 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 |
| D | 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g)?2HI(g),获得等量HI时需要的时间前者少 | 当其他条件不变时,气态反应体系的压强越大,化学反应速率越快 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4与C4H10不一定是同系物 | |
| B. | 苯分子中既含有碳碳单键,又含有碳碳双键 | |
| C. | 乙烯使溴水褪色属于取代反应 | |
| D. | 炒菜时,加入一点酒和醋能使菜味香可口,原因是有酯类物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自来水中通入少量Cl2进行消毒杀菌 | |
| B. | 为漂白银耳大量使用SO2 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢 | |
| D. | 用小苏打发酵面团制作馒头 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
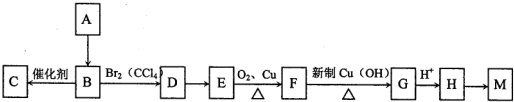
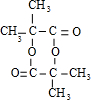 .
.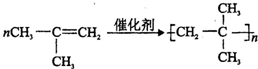 ;E→F
;E→F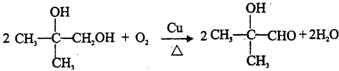 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com