
| A. | 15 种 | B. | 16 种 | C. | 17 种 | D. | 18 种 |
分析 根据C5H12O的分子量为88,和它相对分子质量相同的一元羧酸为丁酸,分子式为C4H8O2的酸的种类取决于-C3H7的种类,分子式为C5H12O的醇的种类取决于-C5H11的种类,-C3H7异构体有2种:-CH2CH2CH3,-CH(CH3)CH3,-C5H11的异构体有8种:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,然后根据题目要求确定酯的种类.
解答 解:分子式为C4H8O2的酸的种类取决于-C3H7的种类,-C3H7异构体有2种:-CH2CH2CH3,-CH(CH3)CH3,即分子式为C4H8O2的酸有2种;
分子式为C5H12O的醇的种类取决于-C5H11的种类,-C5H11的异构体有8种:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-C(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,即分子式为C5H12O的醇有8种,
所以形成的酯共有2×8=16种,
故选B.
点评 本题主要考查同分异构体的书写,难度中等,注意利用戊基、丙基的种类判断.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
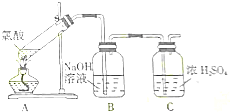
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
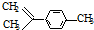 ,有关分析正确的是( )
,有关分析正确的是( )| A. | 一氯代物共有7种 | B. | 分子中所有碳原子一定在同一平面 | ||
| C. | 和 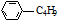 互为同分异构体 互为同分异构体 | D. | 1mol柠檬烯与H2反应最多消耗4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
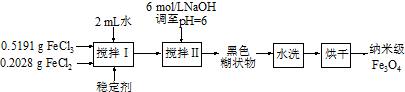
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
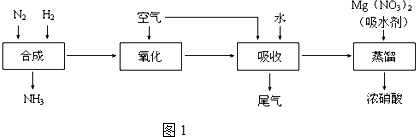
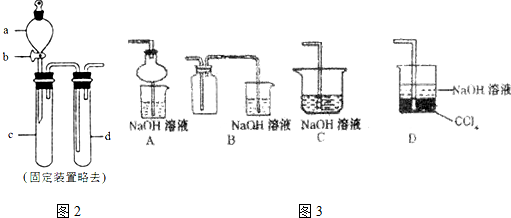
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com