
下列反应的离子方程式书写正确的是
①硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO =BaSO4↓
=BaSO4↓
②将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
③石灰石溶于稀醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
④氯气与水反应:Cl2+H2O=H++Cl-+HClO
⑤小苏打溶液中加少量石灰水:Ca2++2OH-+2HCO =CaCO3↓+CO
=CaCO3↓+CO +2H2O
+2H2O
⑥次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
⑦钠与硫酸铜溶液反应:Cu2++2Na=Cu+2Na+
⑧纯碱溶液中滴加少量盐酸:CO +H+=HCO
+H+=HCO
A.①②⑤ B.②③④⑤⑧
C.④⑤⑥⑦ D.②③⑧
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物
B.用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl会升华
C.SO2气体和Cl2均能使品红溶液褪色,说明两者均有强氧化性
D.浓硫酸不能用来干燥HI、CO、SO2等气体,因为浓硫酸具有强氧化性
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
下列装置或操作能达到实验目的的是

A.用装置甲制取氯气B.用乙装置除去氯气中的HCl气体
C.用丙装置萃取溴水中的溴单质D.用丁装置分离乙酸与乙醇
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
已知a g气体X2中含有b个X原子,那么c g该气体在0℃、1.01×105 Pa条件下的体积是(NA表示阿伏加德罗常数的数值)
A. L B.
L B. L
L
C. L D.
L D. L
L
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
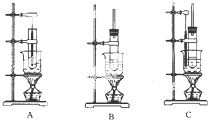 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com