
| A. | c(NH4+)>c(Cl-)>c(OH-)>c( H+) | B. | c(Cl-)>c(NH4+)>c( H+)>c(OH-) | ||
| C. | c(NH4+)+c( NH3)=c(Cl-)+c(OH-) | D. | c(NH4+)+c( NH3•H2O)+c( NH3)=c(Cl-) |
分析 氯化铵溶液中,铵根离子部分水解,溶液呈酸性,所以c(H+)>c(OH-),溶液中存在电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+),则c(Cl-)>c(NH4+),盐类水解程度较小,所以c(NH4+)>c(H+),则溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),据此结合物料守恒判断.
解答 解:A.铵根离子部分水解,则c(H+)>c(OH-),根据电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+)可知c(Cl-)>c(NH4+),盐类水解程度较小,所以c(NH4+)>c(H+),则溶液中离子浓度大小顺序是:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B.根据A的分析可知:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B正确;
C.根据物料守恒可得:c(NH4+)+c( NH3•H2O)+c( NH3)=c(Cl-),故C错误;
D.根据物料守恒可知:(NH4+)+c( NH3•H2O)+c( NH3)=c(Cl-),故D正确;
故选BD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用基础知识的能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | Cu和AgNO3溶液反应 | Cu+Ag+═Cu2++Ag | 正确 |
| B | 氧化铝与NaOH溶液反应 | 2Al3++3O2-+2OH-═2AlO2-+H2O | 错误,Al2O3不应写成离子形式 |
| C | Fe和稀硫酸反应 | 2Fe+6H+═2Fe3++3H2↑ | 正确 |
| D | 钠与硫酸铜溶液反应 | 2Na+Cu2+═Cu+2Na+ | 错误,CuSO4不应写成离子形式 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
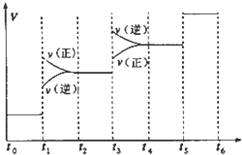 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:| A. | 图中t1时引起平衡移动的条件可能是升高温度 | |
| B. | 表示平衡混合物中NH3的含量最高的一段时间是t5~t6 | |
| C. | 温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为$\frac{16}{{a}_{2}}$ | |
| D. | 在t2~t3时间段,保持容器体积不变,充入一定量的惰性气体,N2的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
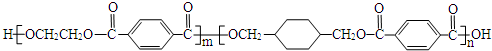
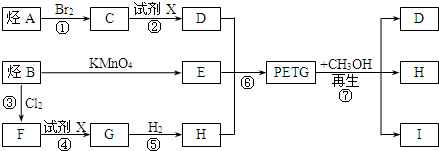
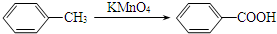
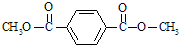 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
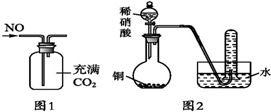
| A. | 汽车尾气中有NOx,主要是汽车打火时氮气和氧气反应引起的 | |
| B. | 可以用图1所示装置收集到干燥的NO气体 | |
| C. | 根据图2装置收集到的气体为无色能够验证铜和稀硝酸反应的产物中气态物质只有NO | |
| D. | 可以用湿润的淀粉碘化钾试纸鉴别红棕色气体NO2和溴蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
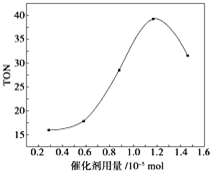
| A. | 由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义 | |
| B. | 在反应体系中添加合适的吸水剂,将提高该反应的TON | |
| C. | 当催化剂用量为1.2×10-5mol时,该反应的TON 达到最高点 | |
| D. | 当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com