
下列说法正确的是
A.向50 mL 1 mol·L-1的盐酸中加入烧碱,水的KW不变
B.NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用
C.有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+)
D.常温下0.1 mol·L-1的HA溶液中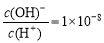 , 则0.01 mol·L-1HA溶液中c(H+)=1×10-4 mol·L-1
, 则0.01 mol·L-1HA溶液中c(H+)=1×10-4 mol·L-1
B
【解析】
试题分析:A、酸碱中和反应是放热反应,温度升高,水的KW增大,错误;B、NH4Cl水解产生一水合氨,所以一水合氨的存在对氯化铵的水解起抑制作用,同理氯化铵对一水合氨的电离也起抑制作用,正确;C、根据盐水解规律“越弱越水解”,NaY水解程度大于NaX水解程度,所以离子浓度大小关系应为c(X-)>c(Y-)>c(OH-)>c(H+),错误;D、常温下0.1 mol·L-1的HA溶液中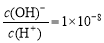 ,可计算出此时c(H+)=1×10-3 mol·L-1,则该酸为弱酸,所以稀释10倍后,c(H+)应略大于原来的1/10,错误,答案选B。
,可计算出此时c(H+)=1×10-3 mol·L-1,则该酸为弱酸,所以稀释10倍后,c(H+)应略大于原来的1/10,错误,答案选B。
考点:考查对水的离子积的理解应用,离子浓度大小的判断,溶液中平衡的移动


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源:2013-2014学年甘肃省张掖市高三第三次诊断考试理综化学试卷(解析版) 题型:填空题
现有分子式为C10H10O2Br2的芳香族化合物X,X中苯环上有四个取代基,苯环上的一氯代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应。
已知:①在稀碱溶液中,连在苯环上的溴原子不易发生水解
②两个羟基同时连在同一碳原子上的结构是不稳定的,它将自动发生脱水反应:
CH3CH(OH)2→CH3CHO +H2O
回答下列问题:
(1)C的结构简式为 ;F→H的反应类型是 。
(2)E不具有的化学性质 (选填序号)
a、取代反应 b、消去反应
c、氧化反应 d、1molE最多能与2mol NaHCO3反应
(3)写出下列反应的化学方程式:
① X与足量稀NaOH溶液共热的化学方程式: ;
② A→B的化学方程式: ;
(4)同时符合下列条件的E的同分异构体共有 种,
a、苯环上的一氯代物有两种 b、不能发生水解反应 c、遇FeCl3溶液不显色
d、1molE最多能分别与1molNaOH和2molNa反应
其中核磁共振氢谱为六组峰,且峰面积比为3:2:2:1:1:1的一种结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省天门市毕业生四月调研测试理综化学试卷(解析版) 题型:填空题
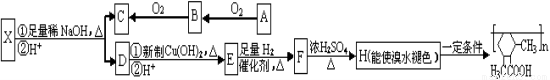
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:
方法二:
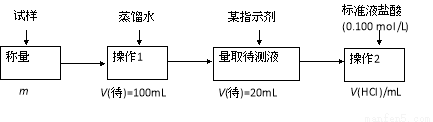
方法三:
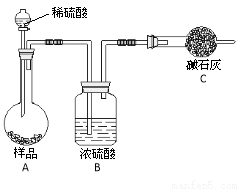
方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A (填写A的化学式)可将HCO3-离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、 、洗涤和 ;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是 ,在操作2中应选择的指示剂是 ;
(3)在方法二中计算该样品中NaHCO3的质量分数为 [用流程图中的数据m、V(HCl) 填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是 ;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是 (均文字简述);
(6)方法四的实验原理是: (用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省商丘市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列关于①乙烯;②苯;③乙醇;④乙酸;⑤葡萄糖等有机物的叙述不正确的是
A.可以用新制的Cu(OH)2悬浊液鉴别③④⑤
B.只有①③⑤能使酸性KMnO4溶液褪色
C.只有②③④能发生取代反应
D.一定条件下,⑤可以转化为③
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省唐山市高三4月第二次模拟理综化学试卷(解析版) 题型:填空题
纯碱(化学式为Na2CO3)是一种重要的化工原料。现代化工生产有三种工艺:
一、布兰制碱法。以食盐为原料制碱,该法分三步:
①用氯化钠与硫酸反应制硫酸钠:2NaCl+H2SO4=Na2SO4+2HCl;
②用焦炭还原硫酸钠得硫化钠:Na2SO4+4C=Na2S+4CO↑
③用硫化钠与石灰石反应制碳酸钠:Na2S+CaCO3=Na2CO3+CaS
二、氨碱法即索尔维制碱法。以食盐、氨、二氧化碳为原料,其反应也分三步进行:
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3+NaCl=NaHCO3+NH4Cl
③2NaHCO3=Na2CO3+CO2↑+H2O
三、候氏制碱法。低温下先向饱和食盐水中通入氨气,再通入二氧化碳可析出碳酸氢钠,再加入细盐末,因同离子效应,低温氯化铵溶解度突然降低,而食盐的溶解度变化不大,所以氯化铵析出而食盐不析出;再用氨饱和后通二氧化碳,结果往返析出NaHCO3和NH4Cl。该法生产的纯碱质量优良,纯白如雪。
(1)通过三种方法的比较,布兰制碱法工艺的缺点有 (写两点)。
(2)氨碱法工艺的中循环利用的物质是 (填化学式);产品的副产物NH4Cl既可以做氮肥又可以重新生成氨气。写出NH4Cl与生石灰反应的化学方程式 。
(3)候氏制碱法反应的方程式为 。
(4)为什么候氏制碱法工艺中先向饱和食盐水中通入氨气,再通入二氧化碳。理由是 (写两点)。
(5)候氏制碱法产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,用m1表示加热前纯碱样品的质量,m2表示加热后固体的质量。则纯碱中碳酸氢钠的质量分数可表示为: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省唐山市高三4月第二次模拟理综化学试卷(解析版) 题型:选择题
下列广告语对应商品中含有的物质有误的是
A.“红梅味精,领先(鲜)一步 ” ——蛋白质
B.“衡水老白干,喝出男人味”——乙醇
C.“吃了钙中钙,腰不疼了,腿不痛了,腰杆也直了”——碳酸钙
D.“要想皮肤好,早晚用大宝”——丙三醇
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省景德镇市高三第一次模拟考试卷理综化学试卷(解析版) 题型:选择题
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:电池:Pb(s)+ PbO2(s)+2H2SO4(aq)= 2PbSO4(s)+ 2H2O(l)
电解池:2Al + 3H2O  Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
| 原电池 | 电解池 |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省南昌市高三3月第一次模拟考试理综化学试卷(解析版) 题型:选择题
已知:①H2(g)+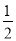 O2(g)=H2O(g)
O2(g)=H2O(g) 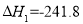 kJ·mol-1,② C(s)+
kJ·mol-1,② C(s)+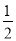 O2(g)=CO(g)
O2(g)=CO(g)  kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)
kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g) 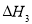 ,则
,则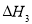 为
为
A.+131.3 kJ·mol-1 B.-131.3 kJ·mol-1
C.+352.3 kJ·mol-1 D.-352.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:K+、Na+、Cu2+、SO42-
B.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl-
C.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42-
D.0.1 mol·L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com