
某化学兴趣小组全体同学进入一家回收含铜电缆废料的工厂做社会调查,工厂负责人向同学们展示两个处理方案,并向同学们提出下列问题:
方案甲:

方案乙:
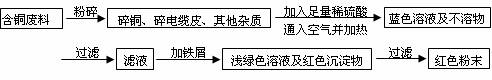
(1)两个方案哪个符合当前生产的绿色理念,为什么?
;
(2)写出方案甲中的②③步骤反应的离子方程式:
;
(3)工厂负责人指出,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,你认为这么说的道理是: ;
(4)用简便方法检验红色粉末中是否含有过量的铁屑 如果有,请你提出合理的处理方案
(5)为了增加经济效益,该工厂把最后一步所得浅绿色滤液通过 、冷却结晶、
、洗涤、自然干燥得到一种俗称“绿矾”的工业产品。
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2009?汕头二模)甲酸(CH2O2),俗称蚁酸,结构式为:
(2009?汕头二模)甲酸(CH2O2),俗称蚁酸,结构式为:




查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组全体同学进入一家回收含铜电缆废料的工厂做社会调查,工厂负责人向同学们展示两个处理方案,并向同学们提出下列问题:
方案甲:
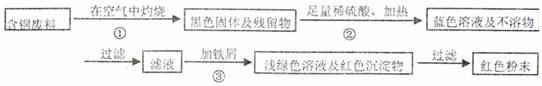
方案乙:
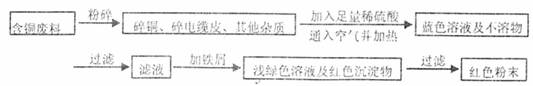
(1)两个方案哪个符合当前生产的绿色理念,为什么?
(2)写出方案甲中的②③步骤反应的离子方程式:
(3)工厂负责人指出,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,你认为这么说的道理是: ;
(4)用简单方法检验红色粉末中是否含有过量的铁屑;如果有请你提出合理的处理方案
;
(5)为了增加经济效益,该工厂把最后一步所得浅绿色滤液通过 、冷却结晶、 、洗涤、自然干燥得到一种俗称“绿矾”的工业产品。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com