
 .
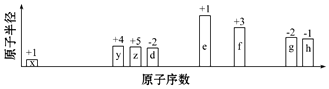
. 分析 x、e的化合价都为+1,x的原子半径最小,e的原子半径最大,则x为H元素、e为Na元素;d的化合价为-2,原子序数小于Na,则d为O元素;y、z的化合价分为+4、+5,结合原子序数大小可知y为C、z为N元素;f的原子序数大于Na元素,化合价为+3,则f为Al元素;g、h的化合价分为-2、-1,原子序数都大于Na元素,则g为S、h为Cl元素,据此结合元素周期律知识解答.
解答 解:x、e的化合价都为+1,x的原子半径最小,e的原子半径最大,则x为H元素、e为Na元素;d的化合价为-2,原子序数小于Na,则d为O元素;y、z的化合价分为+4、+5,结合原子序数大小可知y为C、z为N元素;f的原子序数大于Na元素,化合价为+3,则f为Al元素;g、h的化合价分为-2、-1,原子序数都大于Na元素,则g为S、h为Cl元素,
(1)g为S元素,原子序数为16,位于周期表中第三周期ⅥA族,
故答案为:第三周期ⅥA族;
(2)e、f、g、h对应离子分别为Na+、Al3+、S2-、Cl-,离子的电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,则离子半径大小为:S2->Cl->Na+>Al3+;
y、g、h分别为C、S、Cl元素,非金属性越强,最高价氧化物对应水合物的酸性越强,则其最高价氧化物对应的水化物的酸性从强到弱的顺序是:HClO4>H2SO4>H2CO3,
故答案为:S2->Cl->Na+>Al3+;HClO4>H2SO4>H2CO3;
(3)zh3为NCl3,NCl3为共价化合物,N、Cl最外层都达到8电子稳定结构,其电子式为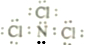 ,
,
故答案为: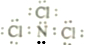 .
.
点评 本题考查位置、结构与性质关系的应用,题目难度不大,根据信息推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 2 种 | B. | 3 种 | C. | 4 种 | D. | 5 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
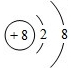 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
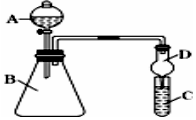 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
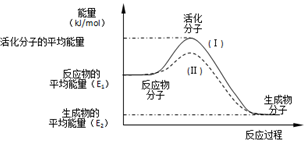 在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.
在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
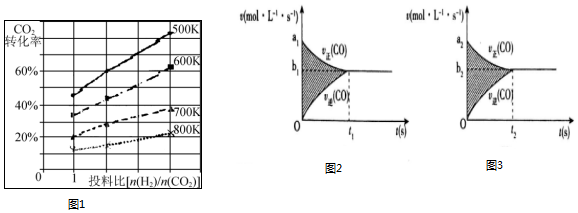
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
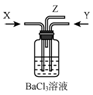 浓硫酸共热产生的气体X和铜和浓硝酸反应产生的气体Y间时通入盛有足量氯化钡溶液的气瓶中(如图装置),下列有关说法不正确的是( )
浓硫酸共热产生的气体X和铜和浓硝酸反应产生的气体Y间时通入盛有足量氯化钡溶液的气瓶中(如图装置),下列有关说法不正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | B. | 洗气瓶中产生的沉淀是亚硫酸钡 | ||
| C. | 洗气瓶中有氧化还原反应发生 | D. | 在Z导管口有红棕色气体出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑦ | B. | ⑤②①③⑥ | C. | ⑤②①④⑦ | D. | ①②⑤③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲为C,X为O2 | B. | 甲为SO2,X为NaOH溶液 | ||
| C. | 甲为Fe,X为Cl2 | D. | 甲为硝酸溶液,X为Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com