
��1��0.1 molij������������������ȫȼ�գ����ɵ�CO2��ˮ��0.6 mol��������ķ���ʽΪ ��
��2������������ʹ��ˮ����������Һ��ɫ������һ�������£����Ժ�Һ�巢��ȡ����Ӧ����һ��ȡ����ֻ��һ�֣���������� �����ṹ��ʽΪ �������� �������Ķ��ȴ����� �֡�
��3����������ʹ��ˮ��ɫ�������ڴ�����������H2�����ӳɷ�Ӧ������2��2���������飬��������� �����ṹ��ʽΪ �� ������ ��
�˴Ź��������� �����շ壬��������� ��
���������У��������Ϊͬϵ�����(�����)_________����Ϊͬ���칹�����________��
�� CH3CH=CHCH3������ �� CH2=CHC(CH3)3
�� CH3CH2CH=CHCH2CH3�� �ܣ�CH3)2CH(CH2)2CH3
��ÿ��1�֣���12�֣�
��1��C6H12 ��2������
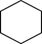 ������ 4
������ 4
��3�� ϩ�� CH2=CHC(CH3)3 3��3-����-1-��ϩ 3 9��1��2 �� �ۡ�
��������
�����������1�������⣬������������������ʽΪCxHy����ȫȼ��ͨʽΪCxHy(g)+(x+y/4)O2(g)��xCO2(g)+y/2H2O(l)�����ڸ÷�Ӧ�и����ʵ�ϵ��֮�ȵ������ʵ���֮�ȣ���x/1=0.6mol/0.1mol��y/2/1=0.6mol/0.1mol����ã�x=6��y=12�����Ը�������ʽΪC6H12����2�����ݷ���ʽ�жϸ���������ϩ���������������ڲ���ʹ��ˮ�����Ը��������Һ��ɫ��˵��������ϩ����������Һ���ܷ���ȡ����Ӧ����һ��ȡ����ֻ��һ�֣�������ǶԳ���ֻ��һ����ԭ�ӵĻ����飻һ�廷����ֻ��һ���Գ��ᣬ��˺���4����ԭ�ӣ���˶���ȡ������4��ͬ���칹�壻��3��ʹ��ˮ��ɫ��˵������Ϊϩ��������ϵͳ�����������������ļӳɲ���Ľṹ��ʽΪCH3C(CH3)2CH2CH3���ɴ����Ƹ�ϩ���Ľṹ��ʽΪCH3C(CH3)2CH=CH2������Ϊ3��3��������1����ϩ������ͬһ̼�������ϵ����Ч�����ϩ�������к���3����ԭ�ӣ������˴Ź�����������3�����շ壻����������ԭ�ӵĸ���֮��Ϊ9��1��2�������֮�ȵ��ڸ�����ԭ����֮�ȣ�������֮��Ϊ9��1��2�����ڸ�ϩ���Ľṹ��ʽΪCH2=CHC(CH3)3������ʽΪC6H12����2����ϩ����ͬϵ�3����ϩ����ͬ���칹�塣
���㣺����ȷ�����ķ���ʽ�ͽṹ���漰���ʵ�������ȼ��ͨʽ�����е�Ӧ�á��������Ľṹ�����ʡ�һ�ȴ���Ͷ��ȴ����ͬ���칹����Ŀ��ϩ�������ʺͽṹ��ϵͳ����������Ч����˴Ź������������շ����������֮�ȡ�ͬһ���ʡ�ͬϵ�ͬ���칹��ȡ�


 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A.��pH=1��CH3COOH��Һ��pH=13��NaOH��Һ�������϶���
B.��1 mL 0.1 mol��L-1��CH3COOH��Һ��10 mL 1 mol��L-1��NaOH��Һ��϶���
C.��0.1 mol��L-1��CH3COOH��Һ��0.1 mol��L-1��NaOH��Һ�������϶���
D.��0.1 mol��L-1��CH3COONa��Һ��0.1 mol��L-1��NaOH��Һ�������϶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��������ɽ����ѧ������ѧ�ڿ�ѧ���Ի�ѧ���� ���ͣ�ѡ����
����11.2 g KOH��ϡ��Һ��1 L 0.1 mol�� L-1��H2SO4��Һ��Ӧ�ų�11.46 kJ����������ʾ�÷�Ӧ���к��ȵ��Ȼ�ѧ����ʽΪ�� ��
A��KOH(aq)+1/2H2SO4(aq) 1/2K2SO4(aq)+H2O(l)����H=��11.46 kJ�� mol-1
1/2K2SO4(aq)+H2O(l)����H=��11.46 kJ�� mol-1
B��2 KOH(aq)+H2SO4(aq) K2SO4(aq)+2H2O(l)����H=��114.6 kJ�� mol-1
K2SO4(aq)+2H2O(l)����H=��114.6 kJ�� mol-1
C��2KOH(aq)+H2SO4(aq) K2SO4(aq)+2H2O(l)����H=��114.6 kJ�� mol-1
K2SO4(aq)+2H2O(l)����H=��114.6 kJ�� mol-1
D��KOH(aq)+1/2H2SO4(aq) 1/2K2SO4(aq)+H2O(l)����H=��57.3 kJ�� mol-1
1/2K2SO4(aq)+H2O(l)����H=��57.3 kJ�� mol-1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com