
【题目】有机物G是一种医药中间体,可通过如图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面上,H的分子式是C7H8。

已知:![]()
请回答以下问题:
(1)A的结构简式是________。
(2)H→I的化学反应方程式为_______ ,
B与银氨溶液反应的化学方程式是________________________________。
(3)C→D的反应类型是________,I→J的反应类型是________。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是______________________。
(5)满足以下条件的F的同分异构体(含F)共有________(填数字)种。
①能与氯化铁溶液发生显色反应
②红外光谱等方法检测分子中有![]() 结构
结构
③苯环上有两个取代基
其中能与碳酸氢钠溶液反应且核磁共振氢谱测定有5个吸收峰的同分异构体的结构简式为__________。
【答案】(1)CH2=CH2 (2) ![]()
CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
(3)取代反应 氧化反应 (4) ![]() (5)12
(5)12 ![]()
【解析】
试题分析:A是石油化工的重要产品且分子中所有原子在同一平面上,结合D的结构简式可知A为CH2=CH2,由转化关系可知,B为CH3CHO,C为CH3COOH,结合G的结构可知F为![]() ,H的分子式是C7H8,不饱和度为(2×7+2-8)÷2=4,H含有一个苯环,H为
,H的分子式是C7H8,不饱和度为(2×7+2-8)÷2=4,H含有一个苯环,H为![]() ,由J的结构可知I为
,由J的结构可知I为![]() ,I发生氧化反应得到J,J发生水解反应得到E(邻醛基苯甲酸),E与甲醇发生酯化反应得到F,
,I发生氧化反应得到J,J发生水解反应得到E(邻醛基苯甲酸),E与甲醇发生酯化反应得到F,
(1)由上述分析可知,A为乙烯,A的结构简式是CH2=CH2;
(2)根据上述分析,H→I的反应方程式为:![]() ;B与银氨溶液反应的化学方程式是CH3CHO+2Ag(NH3)2OH
;B与银氨溶液反应的化学方程式是CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O。
CH3COONH4+2Ag↓+3NH3+H2O。
(3)C→D是CH3COOH中-OH被-Cl取代生成CH3COCl,属于取代反应;I→J是![]() 中甲基被氧化为-COOH,属于氧化反应。
中甲基被氧化为-COOH,属于氧化反应。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是![]() 。
。
(5)满足以下条件的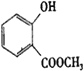 的同分异构体(含F),①能与氯化铁溶液发生显色反应,说明含有酚羟基,②红外光谱等方法检测分子中有
的同分异构体(含F),①能与氯化铁溶液发生显色反应,说明含有酚羟基,②红外光谱等方法检测分子中有![]() 结构,可能含有酯基、可能为羧基;③苯环上有两个取代基,为-OH、-COOCH3,或-OH、-OOCCH3,或-OH、-CH2COOH,或-OH、-CH2OOCH,有邻、间、对三种位置,符合条件的同分异构体有12种(含F);其中能与碳酸氢钠溶液反应,说明含有-COOH,且核磁共振氢谱测定有5个吸收峰,该同分异构体的结构简式为:
结构,可能含有酯基、可能为羧基;③苯环上有两个取代基,为-OH、-COOCH3,或-OH、-OOCCH3,或-OH、-CH2COOH,或-OH、-CH2OOCH,有邻、间、对三种位置,符合条件的同分异构体有12种(含F);其中能与碳酸氢钠溶液反应,说明含有-COOH,且核磁共振氢谱测定有5个吸收峰,该同分异构体的结构简式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。X是同周期中金属性最强的元素,五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位置是 。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: 。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ___,该物质所含有的微粒间作用力的类型为 。
(4)Z的氢化物与W的一种氢化物发生反应可生成Z的单质,写出其化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空。
(1)同温同压下烷烃A蒸气的密度是H2的15倍,烷烃A的分子式:______________;结构简式 。
(2)烷烃B的分子中含有200个氢原子,烷烃B的分子式:________。
(3)含有5个碳原子的烷烃D,烷烃D的分子式: ___________。
(4)分子中含有22个共价键的烷烃,烷烃的分子式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
(一)NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g)△H=+180.50kJmol-1
2NO(g)△H=+180.50kJmol-1
2CO(g)+O2(g)![]() CO2(g)△H=-566.00kJmol-1
CO2(g)△H=-566.00kJmol-1
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参 与大气循环.写出该反应的热化学方程式___________________________;
(2)T℃时,将等物质的量的NO和CO充人容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化如下图所示.
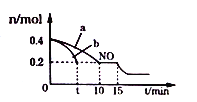
①T℃时该化学反应的平衡常数K=____________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将__________移动;(填“向左”、“向右”或“不”)
②图1中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是_______(填“a”或“b”)
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是____________;
(二)SO2主要来源于煤的燃烧.燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关健。
(3)用纯碱溶液吸收SO2可将其转化为HSO3-,该反应的离子方程式是________________;
(4)如图所示的电解装罝可将雾霾中的NO、SO2分别转化为NH4+和SO42-。
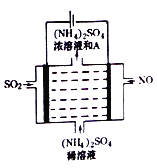
①写出物质A的化学式_________,阳极的电极反应式是________________;
②该电解反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1) Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为_________________________________。
(2) 固体氧化物电解池(SOEC)用于高温电解CO2和H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如右图。

① b为电源的________(填“正极”或“负极”)。
② 写出电极c发生的电极反应式: __________ ______、 __________________ ______。
(3)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g)。对此反应进行如下研究:
CH3OH(g)。对此反应进行如下研究:
某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数值为________,此时向容器中再通入0.35 mol CO气体,则此平衡将________(填“向正反应方向”“不”或“向逆反应方向”)移动。
(4) 已知:
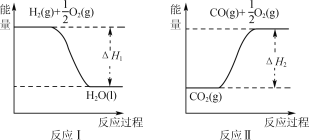
若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g) ![]() CH3OH(l)的ΔH,
CH3OH(l)的ΔH,
则ΔH=______ ____。
(5)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化 过程如下图所示,若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________mol C(碳)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
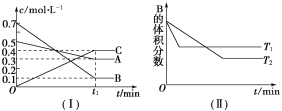
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为 ,正反应为________(填“吸热”或“放热”)反应。
(2)在密闭容器中,加入2 mol A和6 mol B。
① 当反应达到平衡时, A和B的浓度比是_______;A和B的转化率之比是_______。
② 升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③ 当达到平衡时,充入氩气,并保持压强不变,平衡将____(填“正向”、“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质。请回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是_______________(填两种物质的名称),其净水作用的原理是_______________________。
(2)水的净化与软化的区别是______________________________________。
(3)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol·L-1,c(Mg2+)=6×10-4mol·L-1,则此水的硬度为________。
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol·L-1,现要软化10 m3这种天然水,则需先加入Ca(OH)2_______g,后加入Na2CO3_______g。
(5)如图是电渗析法淡化海水的原理图,其中电极A接直流电源的正极,电极B接直流电源的负极。
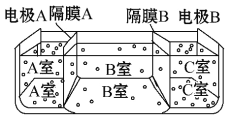
①隔膜A是________(填“阴”或“阳”)离子交换膜;
②某种海水样品,经分析含有大量的Na+、Cl-以及少量的K+、SO42-。若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月5日,从瑞典斯德哥尔摩传来令人振奋的消息:中国女科学家屠呦呦获得2015年诺贝尔生理学或医学奖。理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率。青蒿素的一种化学合成部分工艺流程如下:

已知:羰基![]() H可发生反应应
H可发生反应应![]()
回答下列问题:
(1)青蒿素的含氧官能团名称: 和过氧基;
(2)写出A发生加聚反应的化学方程式 ;
(3)反应B→C,实际上可看作两步进行,依次发生的反应类型是 ;
(4)写出由苯甲醛和氯乙烷为原料,制备苄基乙醛(![]() CH2CH2CHO)的合成路线流程图;无机试剂任用,合成路线流程图示例如下:CH3CH2OH
CH2CH2CHO)的合成路线流程图;无机试剂任用,合成路线流程图示例如下:CH3CH2OH![]() H2C=CH2
H2C=CH2![]() H2C Br-CH2 Br
H2C Br-CH2 Br
。
(5)写出E发生水解反应的化学方程式 。
(6)写出HC(OCH3)3只属于醇的同分异构体的结构简式(同一个碳原子上不能同时连接两个羟基) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下图装置制备家用消毒液,并探究其性质。
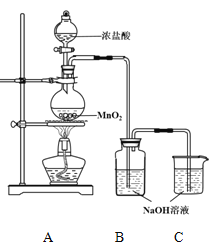
(1)写出装有浓盐酸的仪器名称 ,A中烧瓶内进行的反应中浓盐酸体现出的化学性质是 。
(2)写出装置B中发生的所有反应化学方程式 。
(3)装置c的作用是 。反应停止后,各取洗气瓶中无色溶液5mL分别进行了如下实验:
操作 | 现象 |
A.测溶液pH, 并向其中滴加2滴酚酞 | pH = 13, 溶液变红,5min后褪色 |
B. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(4)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去,为探究操作A中溶液褪色的原因,又补充了如下实验:
操作 | 现象 |
取 NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
获得结论:此实验小组制备的消毒液具有漂白性。
(5)操作B中溶液变成黄绿色的原因: (用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com