
 ,元素的金属性越强最高价氧化物对应的水化物的碱性越强,金属性Ca>Mg,所以Ca(OH)2的碱性比Mg(OH)2 强,故答案为
,元素的金属性越强最高价氧化物对应的水化物的碱性越强,金属性Ca>Mg,所以Ca(OH)2的碱性比Mg(OH)2 强,故答案为 ;强;
;强; ;故答案为:
;故答案为: ;
;

科目:高中化学 来源: 题型:
| A、Si |
| B、SO3 |
| C、Al2O3 |
| D、Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气的摩尔质量是2 g |
| B、氢气的摩尔质量就是其相对分子质量 |
| C、氢的摩尔质量是2 g/mol |
| D、氢气的摩尔质量是2 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
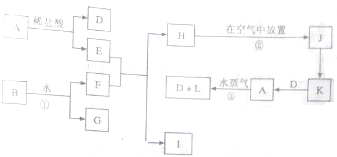
查看答案和解析>>
科目:高中化学 来源: 题型:
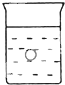 在一烧杯中盛有稀H2S04溶液.同时有一表面光滑的塑料小球悬浮于溶液中央,如图所示.向该烧杯里缓缓注入与稀H2SO4等密度的Ba(OH)2溶液至恰好完全反应.在此实验过程中
在一烧杯中盛有稀H2S04溶液.同时有一表面光滑的塑料小球悬浮于溶液中央,如图所示.向该烧杯里缓缓注入与稀H2SO4等密度的Ba(OH)2溶液至恰好完全反应.在此实验过程中查看答案和解析>>
科目:高中化学 来源: 题型:
 由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了.全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了.全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.查看答案和解析>>
科目:高中化学 来源: 题型:
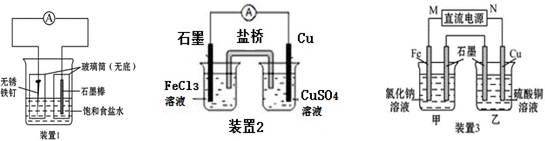
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com