
根据所学的元素周期律知识,下列说法正确的是()
A. 碱金属元素从上到下随核电荷数的增加,单质的熔沸点逐渐升高
B. 第二周期元素(除稀有气体外)从左到右随核电荷数的增加,其最高正价从+1到+7
C. Se的氢化物应该比硫化氢稳定
D. Sr的碳酸盐应该难溶于水
考点: 元素周期表的结构及其应用;元素周期律的作用.
分析: A、碱金属属于金属晶体,从上到下随核电荷数的增加,半径增大,金属键减弱;
B、第二周期元素中O、F没有正价;
C、S、Se同主族,非金属性越强,氢化物越稳定;
D、Sr与Ca同主族,碳酸钙不溶于水.
解答: 解:A、因碱金属属于金属晶体,从上到下,半径增大,金属键减弱,则单质的熔沸点逐渐降低,故A错误;
B、因第二周期元素中O、F没有正价,在第三周期中(除稀有气体外)从左到右随核电荷数的增加,其最高正价从+1到+7,故B错误;
C、S、Se同主族,非金属性S>Se,则Se的氢化物不如硫化氢稳定,故C错误;
D、Sr与Ca同主族,碳酸钙不溶于水,则可知Sr的碳酸盐应该难溶于水,故D正确;
故选D.
点评: 本题考查元素周期表和元素周期律,熟悉元素的性质变化规律是解答本题的关键,并注意利用性质的相似性、递变性来推断,难度不大.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:
用配制好的淀粉溶液进行下列实验,得不到预期实验现象的是( )
A.用聚光手电筒照射,产生丁达尔效应
B.加入碘水,溶液变蓝
C.加入稀硫酸振荡并加热,再加入新制Cu(OH)2悬浊液,有红色沉淀生成
D.加入碘化钾溶液后,无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于无机非金属材料的说法中正确的是 ( )。
A.传统无机非金属材料是指:光导纤维、玻璃、水泥、陶瓷等硅酸盐材料
B.新型无机非金属材料虽然克服了传统无机非金属材料的缺点,但强度比较差
C.高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点
D.传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
某主族元素R的最高化合价与负化合价代数和为6.下列说法正确的是()
A. R的气态氢化物能燃烧
B. R的最高价氧化物为RO3
C. R一定是第ⅦA族元素
D. R的气态氢化物易溶于水显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列观点中,错误的是()
A. 化学反应既能实现物质的转化、又能实现能量的转化
B. 分子是保持物质化学性质的一种粒子
C. 储存在物质中的化学能在化学反应前后是不变的
D. 构成宏观物质的微观粒子之间的相互作用有多种形式,如离子键、共价键等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42﹣)>c(NH4+) |
|
| B. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
|
| C. | pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
|
| D. | 向0.1mol•L﹣1的氨水中加入少量硫酸铵固体,则溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
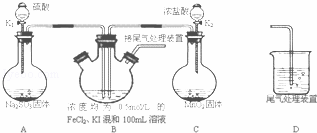
某化学实验小组为验证常见还原剂SO2、I﹣、Fe2+的还原性强弱的顺序为:SO2>I﹣>Fe2+,用图所示装置进行实验(加热和夹持装置已略,气密性已检验).
(1)上述实验需要加热的装置是
(2)A中反应的化学方程式为
(3)D中,烧杯盛放的是
(4)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式
①为验证I﹣的还原性比Fe2+强,取(4)后B中的少量溶液于试管中,应再往试管中滴入 溶液,现象是
②在(4)后,为了比较SO2和I﹣的还原 性强弱,接下来的操作是
性强弱,接下来的操作是
A.打开K1 B.打开K2 C.同时打开K1和K2
(5)若打开K2,通入Cl2恰好将Fe2+、I﹣全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com