
能正确表示下列反应的离子方程式的是( )
A.Cl2通入NaOH溶液:
Cl2+OH-===Cl-+ClO-+H2O
B.NaHCO3溶液中加入稀盐酸:
CO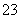 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:
Al3++4NH3·H2O===AlO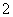 +4NH
+4NH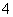 +2H2O
+2H2O
D.Cu溶于稀HNO3:
3Cu+8H++2NO ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
关于一些重要的化学概念有下列说法:①Fe(OH)3胶体和CuSO4溶液都是混合物;②BaSO4是一种难溶于水的强电解质;③冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④煤的干馏、煤的气化和液化都属于化学变化;⑤置换反应都属于离子反应。其中正确的是( )
A.①②⑤ B.①②④
C.②③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列6种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2。按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①________________________________________________________________________。
②________________________________________________________________________。
(2)从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式
________________________________________________________________________
___________________________________ _____________________________________。
_____________________________________。
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系:______________________。
(4)生活中的食醋和淀粉溶液分别属于分散系中的______和________,用________可以鉴别(填化学专用名词)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是( )
A.向Ba(OH)2溶液中滴加稀硫酸:
Ba2++2OH-+2H++SO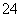 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
B.酸性介质中KMnO4氧化H2O2:
2MnO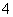 +5H2O2+6H+===2Mn2++5O2↑+8H2O
+5H2O2+6H+===2Mn2++5O2↑+8H2O
C.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-===PbO2+4H++SO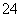
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.光催化还原水制氢比电解水制氢更节能环保、更经济
B.氨氮废水(含NH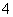 及NH3)可用化学氧化法或电化学氧化法处理
及NH3)可用化学氧化法或电化学氧化法处理
C.某种化学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12 L)内的数个目标分子,据此可推算该检测技术能测量细胞内浓度约为10-12~10-11mol·L-1的目标分子
D.向汽油中添加甲醇后,该混合燃料的热值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:

(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
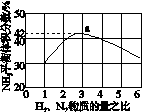

(a) (b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知硫化亚铜与一定浓度的硝酸共热,所得溶液中只有硝酸铜和硫酸铜,放出一氧化氮和二氧化氮两种气体,且两种气体的物质的量之比为3:7,则参加反应的硫化亚铜和作氧化剂的硝酸的物质的量之比是
A.4:25 B.2:17 C.1:7 D.3:8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com