
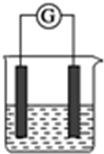
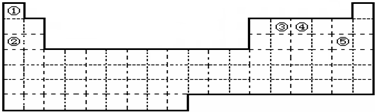
 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成右图所示的原电池装置(只有两个电极),观察到电流计?的指针均明显转偏,则其可能的组合共有( )
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成右图所示的原电池装置(只有两个电极),观察到电流计?的指针均明显转偏,则其可能的组合共有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
科目:高中化学 来源: 题型:选择题
| A. | 不用稀硫酸改用98%的浓硫酸 | B. | 加热 | ||
| C. | 滴加CuSO4溶液 | D. | 不用铁片改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
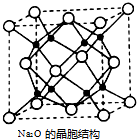 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金属A投入B的盐溶液,A溶解说明A的金属性比B的金属性强 | |
| B. | 用干燥洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,火焰呈黄色,说明该溶液是钠盐溶液 | |
| C. | 合成新型农药可以在元素周期表的金属与非金属交界处区域探寻 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 ml 5%H2O2和1 mlH2O,向另一支试管中加入2 mL 5%H2O2和1 mLFeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的简单离子半径大于W的简单离子半径 | |
| B. | Z的氧化物对应水化物为强酸 | |
| C. | XW2熔沸点较低,可能是共价化合物 | |
| D. | 工业制Y可以电解熔融的YW3制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
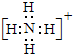
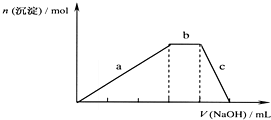
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | C(s)+CO2(g)?2CO(g) (正反应为吸热反应) | |
| C. | 2NO2(g)?N2O4(g) (正反应为放热反应) | |
| D. | 3O2(g)?2O3(g) (正反应为吸热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
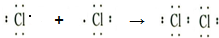 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com