
分析 托盘天平精确度较低,应该选用电子天平;
(1)KMnO4在酸性条件下氧化性更强;
(2)KMnO4溶液能够腐蚀橡胶,应该用酸式滴定管;
(3)根据酸性KMnO4溶液为紫红色,滴定终点时,溶液由无色变为红色,过程中不需要加指示剂;在酸性条件下,高锰酸根离子能和草酸根离子发生氧化还原反应生成二价锰离子、二氧化碳和水;
(4)滴定终点时仰视滴定管刻度,会导致测量体积偏大,测定草酸质量偏大,水的质量偏小,则x值会偏小.
解答 解:托盘天平精确度较低,只能准确度0.1g,称量2.348g草酸钠固体配成250mL溶液,应该选用电子天平;
故答案为:电子天平;
(1)加人适量的稀H2SO4的是增强KMnO4的氧化性;
故答案为:增强KMnO4的氧化性;
(2)KMnO4溶液能够腐蚀橡胶,应该用酸式滴定管盛装;
故答案为:酸式滴定管;
(3)酸性KMnO4溶液为紫红色,当达到滴定终点时,再滴入酸性KMnO4溶液时,紫红色不再褪去,且半分钟内颜色不再变化,说明达到滴定终点;
高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,离子方程式为:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O;
故答案为:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O;否;紫红色不再褪去,且半分钟内颜色不再变化;
(4)滴定终点时仰视滴定管刻度,会导致测量体积偏大,测定草酸质量偏大,则x值会偏小;
故答案为:偏小.
点评 本题考查了氧化还原滴定,虽然基于反应原理与中和滴定不同,但实验原理及操作和所用仪器等类似.由于该反应有明显的颜色变化,故可不可用指示剂.


科目:高中化学 来源: 题型:选择题
| A. | 分子式为C2H4Cl2的物质一定是纯净物 | |
| B. | 分子组成符合CnH2n+2的烃一定是烷烃 | |
| C. | 正戊烷分子中所有碳原子均在一条直线上 | |
| D. | 碳氢原子个数比为1:3的烃有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-6 mol•L-1的溶液一定呈酸性 | |
| B. | PH=7的溶液一定呈中性 | |
| C. | c(OH-)=c(H+)的溶液一定呈中性 | |
| D. | 不能使酚酞试液变红的溶液一定呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 透明的溶液中:Na+、Cu2+、SO42-、Cl- | |
| B. | pH=1的溶液中:Al3+、Mg2+、S2O32-、AlO2- | |
| C. | 能使酚酞变红色的溶液中:Fe3+、Ba2+、HC2O4-、Cl- | |
| D. | 常温下,水电离的c(OH-)=1×10-12mol•L-1溶液中:NH4+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 112.4 (100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
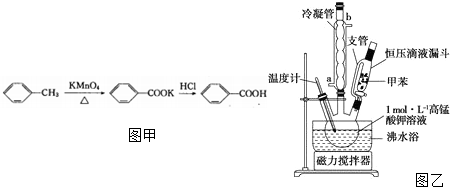
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 22.60 |
| 第二次 | 20.00 | 1.00 | 24.50 |
| 第三次 | 20.00 | 2.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
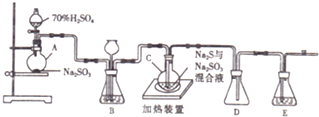
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y和 Z的原子半径大小顺序为 Y>Z>X | |
| B. | Z和 Y组成的化合物中一定既有离子键又有共价键. | |
| C. | 元素 X、Y、W各自最高和最低化合价的代数和分别为 0、4、4 | |
| D. | 同时含有 X、Y、Z、W四种元素的两种不同化合物能相互反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com