
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
分析 ①HSO3-的电离方程式为:HSO3-?H++SO32-,平衡常数表达式为K=$\frac{c({H}^{+})•c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$;
②NaHSO3溶液中存在亚硫酸氢根的水解与电离,水解导致其呈碱性,电离导致其呈酸性,NaHSO3溶液呈酸性,则电离程度大于水解程度,据此分析;
③由表可知H2SO3的二级电离小于H2CO3的一级电离,则酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O.
解答 解:①HSO3-的电离方程式为:HSO3-?H++SO32-,平衡常数表达式为K=$\frac{c({H}^{+})•c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$,故答案为:$\frac{c({H}^{+})•c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$;
②NaHSO3溶液中存在亚硫酸氢根的水解与电离,水解导致其呈碱性,电离导致其呈酸性,NaHSO3溶液呈酸性,则电离程度大于水解程度;故离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
③由表可知H2SO3的二级电离大于H2CO3的一级电离,所以酸性强弱H2SO3>HSO3->H2CO3,所以反应的主要离子方程式为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O,
故答案为:H2SO3+2HCO3-=SO32-+2CO2↑+2H2O.
点评 本题考查盐的水解平衡、弱电解质电离平衡的知识在离子浓度大小比较的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
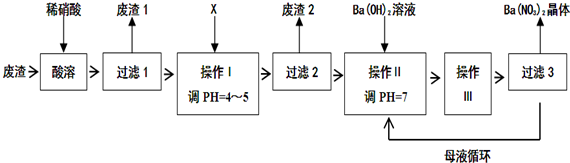
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CCl4鉴别溴水和碘水 | |
| B. | 用AgNO3溶液鉴别溴化钾溶液和氯化钠溶液 | |
| C. | 向某盐溶液中加入氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,溶液中一定有NH4+ | |
| D. | 向某盐溶液中,加入盐酸,产生使澄清石灰水变浑浊的气体,溶液中含有大量CO32-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
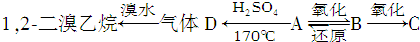 若有A、B、C三种烃的衍生物,相互转化关系如图:C跟石灰石反应产生使石灰水变浑浊的气体.
若有A、B、C三种烃的衍生物,相互转化关系如图:C跟石灰石反应产生使石灰水变浑浊的气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com