
【题目】
过渡元素有特殊性能常用于合金冶炼,p区元素用于农药医药、颜料和光电池等工业。
(l)量子力学把电子在原子核外的一种空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态叫作_______
(2)基态亚铜离子中电子占据的原子轨道数目为____。
(3)Cr3+可以与CN -形成配离子,其中Cr3+以d2sp3方式杂化,杂化轨道全部用来与CN -形成配位键,则Cr3+的配位数为 ______,1 mol该配离子中含有_______ molσ键。
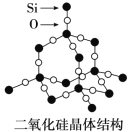
(4)单晶硅可由二氧化硅制得,二氧化硅晶体结构如图所示,在二氧化硅晶体中,Si、O原子所连接的最小环为____元环,则每个O原子连接________个最小环。
(5)与砷同周期的p区元素中第一电离能大于砷的元素有 ________(填元素符号);请根据物质结构的知识比较酸性强弱亚砷酸(H3AsO3,三元酸)____HNO3(填>,=,<)。
(6) Zn与S形成晶胞结构如图所示,晶体密度为p g/cm3,则晶胞中距离最近的Zn、S之间的核间距离是____pm。(NA表示阿伏加德罗常数,用含p、NA等的代数式表示)

【答案】自旋 14 6 12 12 6 Br、Kr < ![]() ×
×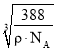 ×1010
×1010
【解析】
(1)对于一个微观体系,它的状态和由该状态所决定的各种物理性质可用波函数ψ表示,在原子或分子体系等体系中,将ψ称为原子轨道或分子轨道,求解薛定谔方程,ψ由主量子数n,角量子数l,磁量子数m决定,即ψ(n,l,m)为原子轨道,实验证明,除了轨道运动外,电子还有自旋运动,由自旋量子数决定;
(2)Cu原子核外电子排布式为1s22s22p63s23p63d104s1,失去4s能级1个电子形成Cu+;
(3) Cr3+可以与CN形成配离子,其中Cr3+以d2sp3方式杂化,杂化轨道全部用来与CN形成配位键,即形成6个配位键,则Cr3+的配位数为6,形成配离子为[Cr(CN)6]3,配位键属于σ键,CN中含有1个σ键;
(4)在二氧化硅晶体,可以看作在晶体硅中每个Si-Si键之间连接O原子,晶体Si中每个Si原子形成4个Si-Si键,由图可知每2个Si-Si键可以形成2个六元环,而4个Si-Si键任意2个可以形成6种组合;
(5)与砷同周期的p区元素中第一电离能大于砷的主族元素有Br和Kr;根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(6)Zn、S的配位数相等,图中两种黑色球的数目均为4,则晶胞中Zn、S原子数目均为4,晶胞质量为4×![]() g,晶体密度为pg/cm3,则晶胞边长x=
g,晶体密度为pg/cm3,则晶胞边长x=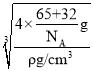 =
=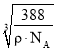 cm,即晶胞边长为x=
cm,即晶胞边长为x=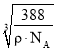 ×1010pm,S原子与周围4个Zn原子形成正四面体结构,令S与Zn之间的距离为y,则正四面体中心到底面中心的距离为
×1010pm,S原子与周围4个Zn原子形成正四面体结构,令S与Zn之间的距离为y,则正四面体中心到底面中心的距离为![]() ,正四面体的高为
,正四面体的高为![]() ,正四面体棱长=
,正四面体棱长=![]() ,则正四面体侧面的高为
,则正四面体侧面的高为![]() ×
×![]() ,底面中心到边的距离为
,底面中心到边的距离为![]() ×
×![]() ×
×![]() ,故(
,故(![]() )2+(
)2+(![]() ×
×![]() ×
×![]() )2=(
)2=(![]() ×
×![]() )2,整理得y=
)2,整理得y=![]() 。
。
(1)对于一个微观体系,它的状态和由该状态所决定的各种物理性质可用波函数ψ表示,在原子或分子体系等体系中,将ψ称为原子轨道或分子轨道,求解薛定谔方程ψ,由主量子数n,角量子数l,磁量子数m决定,即ψ(n,l,m)为原子轨道,实验证明,除了轨道运动外,电子还有自旋运动,由自旋量子数决定,所以电子除空间运动状态外,还有一种运动状态叫做自旋,
故答案为:自旋;
(2) Cu原子核外电子排布式为1s22s22p63s23p63d104s1,失去4s能级1个电子形成Cu+,Cu+基态时电子排布式为1s22s22p63s23p63d10,其电子占据的14原子轨道;
(3) Cr3+可以与CN形成配离子,其中Cr3+以d2sp3方式杂化,杂化轨道全部用来与CN形成配位键,即形成6个配位键,则Cr3+的配位数为6,形成配离子为[Cr(CN)6]3,配位键属于σ键,CN中含有1个σ键,故1mol该配离子中含有12molσ键;
(4) 在二氧化硅晶体,可以看作在晶体硅中每个SiSi键之间连接O原子,晶体Si中每个Si原子形成4个SiSi键,由图可知每2个SiSi键可以形成2个六元环,而4个SiSi键任意2个可以形成6种组合,则每个Si原子连接十二元环数目为6×2=12,每个O原子连接2个Si原子,每个Si原子和该O原子能形成3个最小环,所以每个O原子能形成6个最小环;
(5)As处于周期表中第4周期第ⅤA族,则其核外电子排布式为:[Ar]3d104s24p3,与砷同周期的p区元素中第一电离能大于砷的主族元素有Br和Kr;根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;亚砷酸(H3AsO3)中含有3个羟基氢,为三元酸,没有非羟基氧原子,HNO3为一元酸,含有一个羟基氢,含非羟基氧原子2个,所以酸性:H3AsO3< HNO3;
(6) Zn、S的配位数相等,图中两种黑色球的数目均为4,则晶胞中Zn、S原子数目均为4,晶胞质量为4×![]() g,晶体密度为pg/cm3,则晶胞边长x=
g,晶体密度为pg/cm3,则晶胞边长x=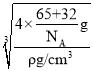 =
=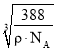 cm,即晶胞边长为x=
cm,即晶胞边长为x=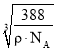 ×1010pm,S原子与周围4个Zn原子形成正四面体结构,令S与Zn之间的距离为y,则正四面体中心到底面中心的距离为
×1010pm,S原子与周围4个Zn原子形成正四面体结构,令S与Zn之间的距离为y,则正四面体中心到底面中心的距离为![]() ,正四面体的高为
,正四面体的高为![]() ,正四面体棱长=
,正四面体棱长=![]() ,则正四面体侧面的高为
,则正四面体侧面的高为![]() ×
×![]() ,底面中心到边的距离为
,底面中心到边的距离为![]() ×
×![]() ×
×![]() ,故(
,故(![]() )2+(
)2+(![]() ×
×![]() ×
×![]() )2=(
)2=(![]() ×
×![]() )2,整理得y=
)2,整理得y=![]() ,故S与Zn的距离为
,故S与Zn的距离为![]() ×
×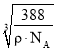 ×1010 pm,
×1010 pm,
故答案为:![]() ×
×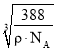 ×1010。
×1010。


科目:高中化学 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题
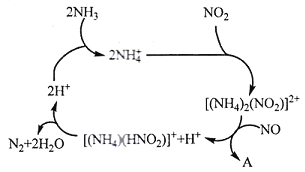
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如下图所示。A包含物质为H2O和___________(填化学式)
(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=___________ kJ/mol
(3)工业上利用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图甲所示。则X可以是___________(填字母序号)
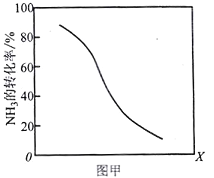
a.温度 b.压强 c.催化剂 d.![]()
②在一定温度下,向2L密闭容器中加入 n mol CH4和2 moI NH3,平衡时NH3体积分数随n变化的关系如图乙所示。
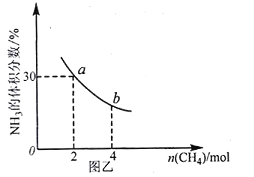
a点时,CH4的转化率为___________%;平衡常数:K(a)_____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为: Mb(ag)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为:
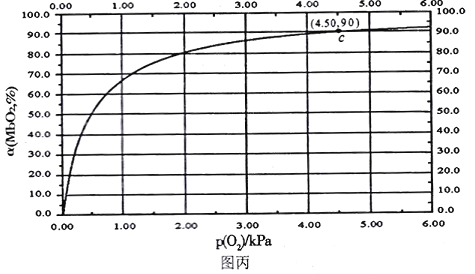
MbO2(aq),该反应的平衡常数可表示为:![]() 。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[
。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[![]() ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
①试写出平衡常数K与速率常数k正、k逆之间的关系式为K=___________(用含有k正、k逆的式子表示)。
②试求出图丙中c点时,上述反应的平衡常数K=___________kPa-1。已知k逆=60s-1,则速率常数k正=___________s-1·kPa-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请回答下列问题:
(1)观察图,标准液盐酸应放入__滴定管中。(填“甲”或“乙”)

(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视__,滴定终点的现象为__。
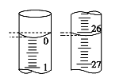
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为__mL,所用盐酸溶液的体积为___mL。
(4)某学生根据3次实验分别记录有关数据如表所示:
滴定次数 | 待测NaOH溶液的体积 | 0.1000mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据表中数据计算该NaOH溶液的物质的量浓度__。
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:下列结论正确的是
离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:下列结论正确的是
步骤 | 操作 | 现象 |
| 用pH试纸检验 | 溶液的pH大于7 |
| 向溶液中滴加氯水,再加入 |
|
| 向 | 有白色沉淀产生 |
| 过滤,向滤液中加入 | 有白色沉淀产生 |
A.肯定含有离子的![]() 、
、![]() 、
、![]()
B.肯定没有的离子是![]() 、
、![]()
C.可能含有的离子是![]() 、
、![]() 、
、![]()
D.不能确定的离子是![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A. ![]() 、
、![]() 、
、![]() 中,所有原子都满足最外层8电子的稳定结构
中,所有原子都满足最外层8电子的稳定结构
B. 在元素周期表中金属和非金属交界处可以找到半导体材料
C. 由非金属元素组成的化合物一定是共价化合物
D. 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,醋酸和氨水的电离平衡常数均为![]() 向10mL浓度为
向10mL浓度为![]() 的
的![]() 溶液中滴加相同浓度的
溶液中滴加相同浓度的![]() 温度变化忽略不计
温度变化忽略不计![]() ,在滴加过程中
,在滴加过程中![]()
A.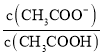 先增大再减小
先增大再减小
B.![]() 与
与![]() 之和始终保持不变
之和始终保持不变
C.水的电离程度始终增大
D.当加入![]() 的体积为10mL时,
的体积为10mL时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置及相应操作正确的是
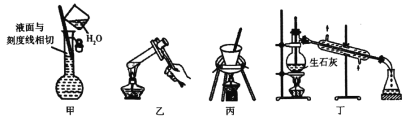
A.图甲可用于配制250ml 0.100mo1/L硫酸溶液时定容操作
B.图乙可用于淀粉在稀硫酸作用下发生水解后,直接滴加新制氢氧化铜悬浊液检验水解产物
C.图丙可用于胆矾结晶水含量测定
D.图丁可用于由工业乙醇制备无水乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 、
、![]() 、
、![]() 的混合溶液中,含有的
的混合溶液中,含有的![]() 、
、![]() 、
、![]() 的个数比是8:1:2,则溶液中
的个数比是8:1:2,则溶液中![]() 、
、![]() 、
、![]() 的物质的量之比为( )
的物质的量之比为( )
A.1:1:1B.1:2:4C.1:3:2D.1:4:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺环化合物具有抗菌活性,用其制成的药物不易产生抗药性。 下列有关四种螺环化合物的说法不正确的是( )
①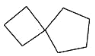 螺[3.4]辛烷 ②
螺[3.4]辛烷 ②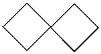 螺[3,3]庚烷 ③
螺[3,3]庚烷 ③![]() 螺[4,4]壬烷 ④
螺[4,4]壬烷 ④![]() 1,4-二氧杂螺[2.2]丙烷
1,4-二氧杂螺[2.2]丙烷
A.①物质一氯代物有 4 种结构B.①②③互为同系物,且螺环烷的分子式通式为CnH2n-2
C.③物质所有碳原子可能处于同一平面D.④与丙烯酸(HCOOCH=CH2)互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com