
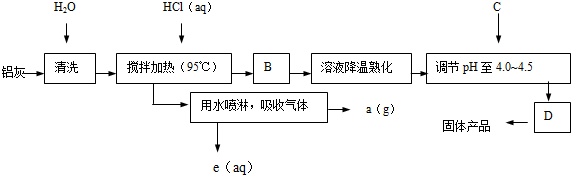
分析 铝灰主要含Al2O3、Al,另有SiO2等杂质,加水清洗后加入氯化氢溶液加热发生的反应是铝和盐酸反应生成氯化铝和氢气,氧化铝和盐酸反应生成氯化铝和水,水喷淋吸收气体得到气体A为氢气;过滤得到滤渣为二氧化硅,滤液为氯化铝,溶液降温熟化调节溶液PH得到通过促进其水解而结晶析出,
(1)铝灰主要含Al2O3、Al,还有SiO2等杂质,加入盐酸,氧化铝和铝能与盐酸反应,二氧化硅不能与盐酸反应.
(2)工艺流程为:铝灰与过量的盐酸反应,过滤后收集滤液,加热浓缩至饱和,调pH值,稍静置,过滤收集滤渣,最终的这个滤渣就是我们要的晶体.
(3)搅拌加热操作过程,加入盐酸,铝与盐酸反应,由氢气生成,加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到HCl(aq),剩余气体为氢气.
(4)95°C加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到HCl(aq),进行循环使用.
(5)溶液调pH值,促进铝离子水解,利用晶体析出.
(6)加入C目的是调节pH值,促进铝离子水解,但不能移入新杂质,其次在流程图中的B中或多或少会留有少量的HCl,因为加热不能保证所有的HCl全部挥发.
解答 解:(1)氧化铝与盐酸反应生成氯化铝和水,反应离子方程式为Al2O3+6H+=2Al3++3H2O;铝与盐酸反应生成氯化铝与氢气,反应离子方程式为2Al+6H+=2Al3++3H2↑.
故答案为:Al2O3+6H+=2Al3++3H2O;2Al+6H+=2Al3++3H2↑;
(2)铝灰与过量的盐酸反应,过滤后收集滤液,加热浓缩至饱和,调pH值,稍静置,过滤收集滤渣,最终的这个滤渣就是我们要的晶体,所以生产过程中操作B和D的均为过滤.
故答案为:过滤;
(3)搅拌加热操作过程,加入盐酸,铝与盐酸反应,有氢气生成,加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到HCl(aq),剩余气体为氢气,反应中副产品a为H2.
故答案为:H2;
(4)95°C加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到HCl(aq),可进行循环使用.
故答案为:HCl;
(5)铝离子水解,Al3++3H2O?Al(OH)3+3H+,降低氢离子浓度促进铝离子水解,有利于聚合氯化铝晶体析出.
故答案为:促进AlCl3水解,使晶体析出;
(6)用氢氧化钠和氨水调节pH值,会引入新的杂质,引入钠离子和铵根离子.所以可以加入Al和氧化铝进行处理,它二者是固体,多了可以过滤掉的,所以可以使得到的晶体较纯净.
故答案为:BD.
点评 以聚合氯化铝晶体的制备为载体,考查铝及其化合物性质、离子方程式、对工艺流程的理解、除杂等,难度中等,关键在于对工艺流程的理解和知识的迁移运用.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
 纳米级二氧化锰的活性很高,以二氧化锰为电极构成的燃料电池如图所示.下列说法不正确的是 ( )
纳米级二氧化锰的活性很高,以二氧化锰为电极构成的燃料电池如图所示.下列说法不正确的是 ( )| A. | a极为正极,发生还原反应 | |
| B. | b极的电极反应式为(CH2O)n-4ne-+n H2O=nCO2+4n H+ | |
| C. | 电子由b极流出经用电器流向a极 | |
| D. | 放电时H+由质子交换膜左侧向右侧迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12L | B. | 2.24L | C. | 3.36L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
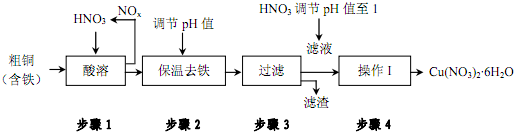
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
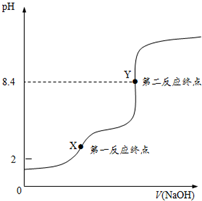 H2C2O4•2H2O(草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液.
H2C2O4•2H2O(草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液.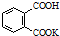 ,摩尔质量为204g•mol-1,易溶于水的固
,摩尔质量为204g•mol-1,易溶于水的固查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL 1 mol•L-1的KNO3溶液 | |
| B. | 500 mL 1 mol•L-1的Ba(NO3)2溶液 | |
| C. | 1000 mL 0.5 mol•L-1的Mg(NO3)2溶液 | |
| D. | 1000 mL 0.5 mol•L-1的Fe(NO3)3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com