
如图为元素周期表中短周期的一部分。a原子的最外层上有5个电子,下列说法中不正确的是( )
| d | ||
| a | b | c |
A.d的单质可与b的氢化物的水溶液反应
B.a的最高价氧化物对应的水化物比b的最高价氧化物对应的水化物的酸性弱
C.b的氢化物比c的氢化物稳定
D.原子半径:a>b>c
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。

①写出该反应的化学方程式_______________________ 计算从反应开始到3 min时,氢气的平均反应速率v(H2)=____________________。
②下列措施中一定能使CO2的转化率增大的是___________________ 。
A 在原容器中再充入1 mol H2 B 在原容器中再充入1 mol CO2
C 缩小容器的容积 D 使用更有效的催化剂
E.在原容器中充入1 mol He F.将水蒸气从体系中分离出
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
(3)在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
|
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则该反应的反应热a值________(填“增大”、“减小”或“不变”)。
③在一定温度下,增大 的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.元素性质的周期性变化是指原子半径、元素的主要化合价及原子核外电子排布的周期性变化
B.元素性质的周期性变化决定于元素原子结构的周期性变化
C.从Li F, Na
F, Na  Cl,元素的最高化合价均呈现从 +1价
Cl,元素的最高化合价均呈现从 +1价  +7价的变化
+7价的变化
D.电子层数相同的原子核外电子排布,其最外层电子数均从1个到8个呈现周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
国际无机化学命名委员会在1989年作出决定,把长式周期表原先的主、副族及族号取消,从左到右
改为第 1~18列,第ⅠA族为第1列,稀有气体元素为第18列。按此规定,下列说法不正确的是( )
A.第15列元素的最高价氧化物为R2O5 B.第2列元素中肯定没有非金属元素
C.第17列元素的第一种元素无含氧酸 D.第16、17列元素都是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种短周期元素,其元素特征信息如下表:回答下列问题:
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1) 写出下列元素的名称:C E
(2) 写出A、B、C形成的化合物M的电子式
(3) 实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为
(4) D单质与M的水溶液反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人。已知合成氨的反应为N2(g)+3H2(g) 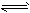 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
Ⅰ.在体积为2L的恒温、恒容密闭容器甲中,起始时投入2 mol N2、3 mol H2,经过
10 s达到平衡,测得平衡时NH3的物质的量为0.8 mol。
Ⅱ.在容器乙中,起始时投入3 mol N2、n mol H2,维持恒温、恒压达到平衡,测得平衡时NH3的物质的量为1.2 mol。此时与容器甲中平衡状态温度相同,相同组分的体积分数都相同。
(1)容器甲10 s内用H2表示的平均反应速率v(H2)=______________________,达平衡时N2的转化率=________________。
(2)甲容器中反应的逆反应速率随时间变化的关系如右下图。t2时改变了某一种条件,改变的条件可能是_____________________、____________________(填写两项)。
 (3)下列哪些情况不能表明容器乙已达平衡状态__________(填字母)。
(3)下列哪些情况不能表明容器乙已达平衡状态__________(填字母)。
A.容器乙中的气体密度不再变化 B.氨气的生成速率等于氮气的消耗速率的2倍
C.断裂1 mol N≡N键同时断裂6 mol N—H键
D.容器乙中气体的平均相对分子质量不随时间而变化
(4) n=_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应2NO2 2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
①单位时间内生成n mo1 O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com