
| A、0.10mol?L-1HA溶液能使紫色石蕊试液变红 |
| B、0.10mol?L-1HA溶液能够与鸡蛋壳反应生成CO2气体 |
| C、0.10mol?L-1NH4Cl溶液呈酸性,0.10mol?L-1NH4A溶液呈中性 |
| D、等体积的0.10mol?L-1HA溶液与0.10mol?L-1NaOH溶液恰好完全反应 |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
 四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该气体的摩尔质量为34 |
| B、标准状况下,该气体的摩尔体积为22.4L |
| C、17g该气体物质的量为0.5 mol |
| D、该500 mL溶液物质的量浓度为2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3-C-18OHO和CH3CH2OH |
| B、CH3-C-18OHO和CH3CH2-18OH |
| C、CH3-C-18OH18O和CH3CH2-18OH |
| D、CH3-C-OHO和CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | AgI | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp(25℃) | 8.3×10-12 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-26 |
| A、氢氧化钠 | B、硫化钠 |
| C、碘化钾 | D、氢氧化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
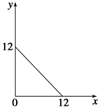 某温度(T℃)下的溶液中,c(H+)=10-x mol?L-1,c(OH-)=10-y mol?L-1,x与y的关系如图所示,请回答下列问题:
某温度(T℃)下的溶液中,c(H+)=10-x mol?L-1,c(OH-)=10-y mol?L-1,x与y的关系如图所示,请回答下列问题:| 实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
| 甲 | 乙 | 丙 | 丁 | |
| 0.1mol?L-1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
| 0.1mol?L-1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com