
| A. | v(N2O5)=1.80×10-3 mol•L-1•min-1 | B. | v(N2O5)=1.08×10-2 mol•L-1•min-1 | ||
| C. | v(NO2)=1.80×10-3 mol•L-1•min-1 | D. | v(O2)=1.80×10-2 mol•L-1•min-1 |
分析 根据v=$\frac{△c}{△t}$、化学反应速率之比等化学计量数之比进行计算
解答 解:v(N2O5)=$\frac{0.0408mol/L-0.030mol/L}{1min}$=1.08×10-2mol•L-1•min-1,化学反应速率之比等于化学方程式计量数之比,
v(N2O5):v(NO2)=1:2,故v(NO2)=2v(N2O5)=2×1.08×10-2mol=3.16×10-2mol•L-1•s-1;
v(N2O5):v(O2)=2:1,故v(O2)=0.5v(N2O5)=0.5×1.08×10-2mol=5.4×10-3mol•L-1•s-1;
故选B.
点评 本题考查化学反应速率的相关计算,把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键,题目难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 同分异构体数目 |
| A | C4H8O2 | 1 |
| B | C6H12O2 | 2 |
| C | C8H16O2 | 3 |
| D | C10H20O2 | 4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔、沸点 | |
| B. | 棉花、蚕丝的主要成分都是纤维素 | |
| C. | 常温常压下,0.1 mol D${\;}_{2}^{18}$O中含有的中子数、质子数、电子数均为NA | |
| D. | 乙烯和苯都能使溴水中的水层褪色,褪色的原因相同 |
查看答案和解析>>
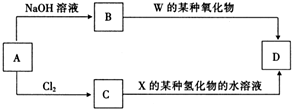
科目:高中化学 来源: 题型:推断题
| W | X | ||
| Y | Z |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
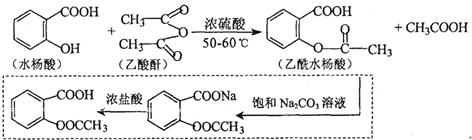
 .
. .
.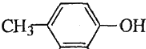 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+CuSO4=FeSO4+Cu | B. | Cl2+H2O=HCl+HClO | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | AgNO3+HCl=AgCl↓+HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com