
| A. | 不能自发进行的氧化还原反应,通过电解的原理可以实现 | |
| B. | 电镀时保持电流恒定,升高温度不改变电解反应速率 | |
| C. | 电解精炼铜电解槽底部会形成含少量Ag、Fe、Pt等金属的阳极泥 | |
| D. | 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 | |
| E. | MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液,若电解电路中通过2mol电子,MnO2的理论产量为1mol | |
| F. | 燃料电池是将燃料燃烧所放出的能量转化为化学能的装置 |
分析 A.不能自发进行的氧化还原反应,通过电解的原理有可能实现,如铜和稀硫酸的反应;
B.电解反应速率只与电流强度有关;
C.电解时,阳极先氧化活泼性较强的金属;
D.可分别在燃料电池的两极通入气体;
E.阳极反应式为:MnSO4-2e-+2H2O═MnO2+SO42-+4H+,根据电极方程式计算;
F.燃料电池是将化学能转化为电能的装置.
解答 解:A.不能自发进行的氧化还原反应,通过电解的原理有可能实现,如铜和稀硫酸的反应,铜为阳极被氧化,可生成硫酸铜,故A正确;
B.电镀时保持电流恒定,即单位时间内转移的电子数恒定,则消耗的反应物与产生的生成物的量恒定,也就是反应速率恒定,与温度无关,故B正确;
C.金属的活动性顺序为Zn>Fe>Cu>Ag>Pt,因此Ag、Pt不会放电,以单质形式沉积下来,故C正确;
D.通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-=2H+,通入氧气的一极为原电池的正极,电极反应式为O2+4H++4e-=2H2O,氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置,故D正确;
E.阳极反应式为:MnSO4-2e-+2H2O═MnO2+SO42-+4H+,若电路中通过2mol电子产生1molMnO2,故E正确;
F.燃料电池是将化学能转化为电能的装置,故F错误.
故选F.
点评 本题考查较为综合,涉及电解池和原电池知识,难度不大,注意把握原电池和电解池的工作原理,学习中注意相关基础知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫能漂白某些物质,说明它具有氧化性 | |
| B. | 二氧化硫的水溶液能使紫色石蕊试液变红,说明它能与水反应生成H2SO3 | |
| C. | 将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性 | |
| D. | 将等体积的SO2和Cl2混和后通入滴有石蕊的水中,溶液的颜色将变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备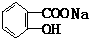
 与NaOH的醇溶液共热制备CH3-CH=CH2.
与NaOH的醇溶液共热制备CH3-CH=CH2.| A. | ① | B. | ①② | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
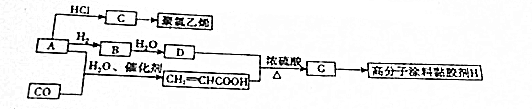
 ,A→C的反应类型:加成反应.
,A→C的反应类型:加成反应.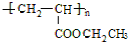 ,写出D的同分异构体的结构简式:CH3OCH3.
,写出D的同分异构体的结构简式:CH3OCH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com