
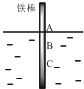
 如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法错误的是( )
如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法错误的是( )| A. | 该腐蚀过程属于电化腐蚀 | |
| B. | 铁棒AB段电极反应为O2+2H2O+4e→4OH- | |
| C. | 铁棒AB段是负极,BC段是正极 | |
| D. | 产生此现象的根本原因是铁棒所处化学环境的不同 |
分析 铁板在水溶液中发生吸氧腐蚀,属于原电池,BC段作原电池负极、AB段作原电池正极,据此解答即可.
解答 解:铁板在水溶液中发生吸氧腐蚀,属于电化学腐蚀,BC段作原电池负极、AB段作原电池正极.
A、铁板在水溶液中发生吸氧腐蚀,属于电化学腐蚀,故A正确;
B、依据分析可知,AB段为原电池的正极,发生反应O2+4e-+2H2O=4OH-,故B正确;
C、由于AB段产生较多铁锈,BC段腐蚀严重,故BC段作原电池负极、AB段作原电池正极,故C错误;
D、此原电池的构成是由于铁棒所处的化学环境不同,故D正确.
故选C.
点评 本题考查金属的吸氧腐蚀,明确各个电极上发生的反应及离子移动方向即可解答,会正确书写电极反应式,知道铁锈的成分,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 保持容器容积不变,向其中加入1molI2,化学反应速率不变 | |
| B. | 保持容器容积不变,向其中加入1molHe,化学反应速率增大 | |
| C. | 保持容器内气体压强不变,向其中加入1 mol H2(g)和1molI2(g),化学反应速率不变 | |
| D. | 保持容器内气体压强不变,向其中加入1molHe,化学反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
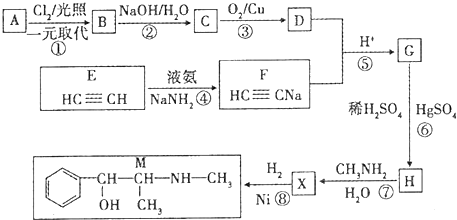
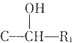
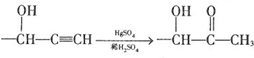
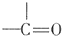 $→_{H_{2}O}^{RNH_{2}}$
$→_{H_{2}O}^{RNH_{2}}$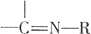
 .
.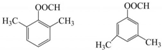 .
.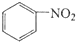 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$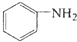 参照上述路线,设计以苯、乙醛为主要原料合成某药物中间体
参照上述路线,设计以苯、乙醛为主要原料合成某药物中间体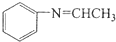 的路线
的路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
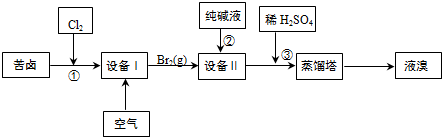
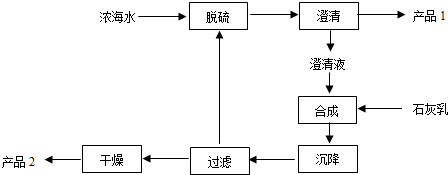
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 相同条件下与金属钠反应的速率,乙醇比乙酸慢 | |
| C. | 医用酒精属于混合物,醋酸是一元弱酸 | |
| D. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | Ca(HCO3)2与澄清石灰水反应 | ||
| C. | NaHCO3与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、糖和醋都可做食品防腐剂 | |
| B. | 青蒿素可以用于治疗疟疾 | |
| C. | 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析 | |
| D. | 油脂在碱性条件下的水解反应称为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 现象 |
| Ⅰ | 先向2mL0.1mol•L-1FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | 滴加KSCN后溶液无明显变化, 加入氯水后溶液变成血红色. |
| Ⅱ | 先向2mL0.1mol•L-1FeCl3溶液中滴加KSCN溶液,再滴加0.1mol•L-1KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加0.1mol•L-1KI溶液后,血红色无明显变化 |
| 编号 | 操作 | 现象 |
| Ⅲ | 向2mL0.1mol•L-1KI溶液中滴加1mL 0.1mol•L-1FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2mL0.1mol•L-1KI溶液中滴加1mL 0.1mol•L-1 FeCl3,溶液变黄色,取该溶液于两支试管中, 试管①中滴加滴加淀粉溶液(或CCl4), 试管②中滴加滴加铁氰化钾溶液. | 预期现象①溶液变蓝 (或溶液分层,下层溶液为紫红色),②出现特征蓝色沉淀. 结论Fe3+能与I-发生氧化还原反应,生成I2和Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
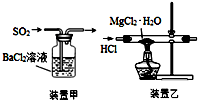
| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 将2.5gCuSO4•5H2O溶于水配成100.0mL溶液,得到0.1mol•L-1硫酸铜溶液 | |
| C. | 用装置甲吸收SO2 | |
| D. | 用装置乙制取无水MgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com