
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,ΔS=+133.7J?(K?mol) -1
CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,ΔS=+133.7J?(K?mol) -1
①该反应能否自发进行与 有很大关系;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 molH—O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
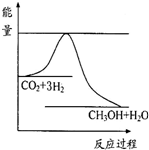
(2)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生如下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,
CH3OH(g)+H2O(g) ,
右图表示该反应进行过程中能量(单位为kJ?mol-1)的变化。
在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,
下列措施中能使c (CH3OH)增大的是 。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
(10分)(1)① 温度(2分) ② b 、c (4分) (2)c、d (4分)
解析试题分析:(1)①由于该反应是吸热的、熵值增大的可逆反应,所以该反应能否自发进行与
温度有很大关系。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,d不能说明。由于该反应是体积可变的,则压强始终是不变的,a不能说明。bc中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,可以说明,答案选bc。
(2)根据图像可知,反应物的总能量高于生成物的总能量,所以反应是放热反应。升高温度,平衡向逆反应方向移动,则c (CH3OH)降低。充入He(g),使体系压强增大,但平衡不移动,c (CH3OH)不变;将H2O(g)从体系中分离出来,平衡向正反应方向进行,c (CH3OH)增大。再充入1mol CO2和3mol H2,相当于是增大压强,平衡向正反应方向进行,c (CH3OH)增大,答案cd。
考点:考查应自发性、平衡状态的判断以及外界条件对平衡状态的影响
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固和训练。该题的关键是明确外界条件是如何影响平衡状态的以及平衡状态的判断依据,然后依据图像和方程式灵活运用即可。有利于培养学生的逻辑推理能力,提高学生分析、归纳、总结问题的能力。


科目:高中化学 来源: 题型:
| [CO]?[H2] |
| [H2O] |
| [CO]?[H2] |
| [H2O] |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
| 高温 |
| 实验 组别 |
温度℃ | 起始量/mol | 平衡/mol | 达平衡所 需时间/min | ||||
| H2O | CO | H2 | CO2 | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 0 | a | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0 | b | 0.4 | 1.6 | 3 |
| 高温 |
| 组别 | 温度 | 催化剂 | … |
| 1 | |||
| 2 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| 2 | 830 | 1 | 4 | 0.8 | 0.8 | 3 |
| 3 | 830 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
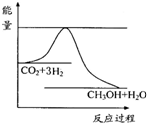 (2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com