
 .
. +(n-1)H2O
+(n-1)H2O
分析 有机物A相对分子质量为100,1mol A充分燃烧后只生成4mol CO2和2mol H2O,根据原子守恒知,A分子中含有4个C原子、4个H原子,A的相对分子质量为100,根据元素守恒知,A中含有O元素,O原子个数=$\frac{100-12×4-1×4}{16}$=3,A能和碳酸氢钠反应说明含有羧基,A能和氢气发生加成反应说明含有碳碳不饱和键,A不饱和度=$\frac{4×2+2-4}{2}$=3,A能发生银镜反应说明含有醛基,A发生氧化反应生成B,B和溴发生加成反应生成D,D的碳链没有支链,则A的结构简式为HOOCCH=CHCHO,C为NaOOCCH=CHCHO、E为HOOCCH2CH2CH2OH,E发生酯化反应生成F,F为 ;
;
A被氧化生成B,B结构简式为HOOCCH=CHCOONH4,B酸化后与Br2反应得到D,D结构简式为HOOCCHBrCHBrCOOH,据此分析解答.
解答 解:有机物A相对分子质量为100,1mol A充分燃烧后只生成4mol CO2和2mol H2O,根据原子守恒知,A分子中含有4个C原子、4个H原子,A的相对分子质量为100,根据元素守恒知,A中含有O元素,O原子个数=$\frac{100-12×4-1×4}{16}$=3,A能和碳酸氢钠反应说明含有羧基,A能和氢气发生加成反应说明含有碳碳不饱和键,A不饱和度=$\frac{4×2+2-4}{2}$=3,A能发生银镜反应说明含有醛基,A发生氧化反应生成B,B和溴发生加成反应生成D,D的碳链没有支链,则A的结构简式为HOOCCH=CHCHO,C为NaOOCCH=CHCHO、E为HOOCCH2CH2CH2OH,E发生酯化反应生成F,F为 ;
;
A被氧化生成B,B结构简式为HOOCCH=CHCOONH4,B酸化后与Br2反应得到D,D结构简式为HOOCCHBrCHBrCOOH,
(1)A的结构简式为HOOCCH=CHCHO,1mol A与2mol H2反应生成1mol E,E为HOOCCH2CH2CH2OH,其反应方程式是HOOCCH=CHCHO+2H2$\stackrel{一定条件下}{→}$HOOCCH2CH2CH2OH,
故答案为:HOOCCH=CHCHO+2H2$\stackrel{一定条件下}{→}$HOOCCH2CH2CH2OH;
(2)A为HOOCCH=CHCHO,与A具有相同官能团的A的同分异构体的结构简式是HOOCC(CHO)=CH2,故答案为:HOOCC(CHO)=CH2;
(3)B酸化后与Br2反应得到D,B酸化后和溴发生加成反应生成D,所以其反应类型是加成反应,故答案为:加成反应;
(4)F的结构简式是 ,故答案为:
,故答案为: ;
;
(5)E为HOOCCH2CH2CH2OH,E通过缩聚反应生成高分子化合物的方程式nHOOCCH2CH2CH2OH$\stackrel{一定条件下}{→}$ +(n-1)H2O,
+(n-1)H2O,
故答案为:nHOOCCH2CH2CH2OH$\stackrel{一定条件下}{→}$ +(n-1)H2O.
+(n-1)H2O.
点评 本题考查有机物推断,为高频考点,正确判断A结构简式是解本题关键,结合反应条件、分子式进行推断,知道常见有机反应类型及反应条件,难点是缩合反应方程式的书写,题目难度中等.


科目:高中化学 来源: 题型:填空题
 ,其化学键的类型为离子键、共价键.
,其化学键的类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:②>③ | B. | 电负性:③>② | ||
| C. | 晶格能:NaCl>NaF | D. | 最高正化合价:③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
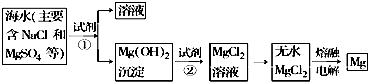
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
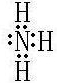 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 焰色反应呈黄色 |
| D | 与B同主族的短周期元素 |
| E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | 元素Z、W的简单离子的电子层结构不同 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Al3+、CO32-、Cl- | B. | Na+、H+、SO42-、SiO32- | ||
| C. | H+、NH4+、SO42-、I- | D. | H+、Fe2+、Cl-、ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com