
【题目】实验室为探究铜与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法错误的是( )
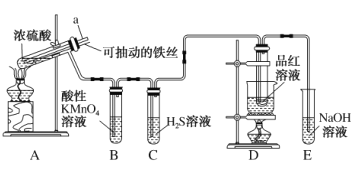
A.装置B、C的目的分别是验证二氧化硫的还原性、氧化性
B.实验结束后可向装置A的溶液中加水,以验证是否有蓝色溶液生成
C.装置D的目的是验证SO2的漂白性及漂白的不稳定性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
【答案】B
【解析】
A. 酸性高锰酸钾溶液具有强氧化性,装置B中酸性高锰酸钾溶液褪色,体现SO2的还原性,H2S溶液与SO2反应生成淡黄色沉淀生成,其反应方程式为:2H2S+SO2=3S↓+2H2O,体现SO2的氧化性,A正确;
B. Cu与浓硫酸反应生成硫酸铜,加水则溶液呈蓝色,但因反应后的溶液中混有浓硫酸,在反应后的溶液中直接加水,放出大量的热,可导致酸液飞溅,应将反应后的酸液沿烧杯内壁缓缓加入到盛有水的烧杯中,并不断用玻璃棒搅拌,B错误;
C. 品红溶液褪色说明SO2具有漂白性,再加热,品红溶液恢复到原来的颜色,说明SO2的漂白性不稳定,是可逆的,不彻底的,C正确;
D. 导管a的作用是使内外压强相同,防止装置B中的溶液倒吸,D正确;
故答案为:B。


科目:高中化学 来源: 题型:
【题目】下列关于物质结构的命题中,错误的项数有( )
①CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
②元素Ge位于周期表第四周期IVA族,核外电子排布式为 [Ar]4s24p2,属于p区
③非极性分子往往具有高度对称性,如BF3、PCl5、H2O2、CO2这样的分子
④Na2O、Na2O2、NaHSO4晶体中的阴、阳离子个数比均为1 :2
⑤Cu(OH)2是一种蓝色絮状沉淀,既能溶于硝酸、也能溶于氨水,是两性氢氧化物
⑥氨水中大部分NH3与H2O以氢键(用“...”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式可记为: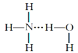
⑦HF沸点高于HCl,是因为 HCl共价键键能小于HF
⑧可燃冰中甲烷分子与水分子之间存在氢键
A.4项B.5项C.6项D.7项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值.下列说法正确的是( )
A.46g乙醇中存在的共价键总数为7NA
B.HNO3作为氧化剂得到的电子数一定为3NA
C.1mol甲醇完全燃烧时,转移的电子数为6NA
D.将3.4g H2S全部溶于水,所得溶液中HS-和S2-离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林的有效成分是乙酰水杨酸(![]() )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
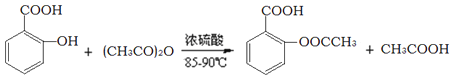
操作流程如下:
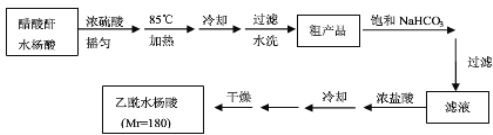
已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是______________。
(2)提纯粗产品流程如下,加热回流装置如图:
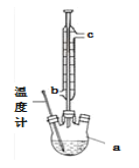
①沸石的作用是_______________;
②冷凝水的流出方向是____________(填“b”或“c”);
③使用温度计的目的是____________。
(3)检验最终产品中是否含有水杨酸的化学方法是_________________。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品m g;Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;Ⅲ.向锥形瓶中滴加几滴酚酞,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
① 写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式______________。
② 阿司匹林药片中乙酰水杨酸质量分数的表达式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)T1K时,将1mol二甲醚引入一个抽空的150L恒容容器中,发生分解反应:CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由此计算:反应达平衡时,二甲醚的分解率为______,该温度下平衡常数Kc=______。(填数值)
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),在恒温恒容下,若要缩短上述反应达到平衡的时间,可采取的措施有______、______。
(2)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)CH3CHO(g)。反应速率v=v正v逆=k正p(CO)p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,当CO转化率为20%时,![]() =______。
=______。
(3)工业上常用高浓度的K2CO3溶液吸收CO2得到溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
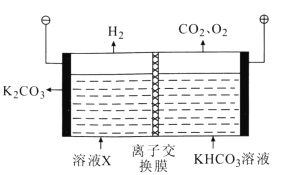
①在阳极区发生的反应包括(电极反应)______和H++![]() =CO2↑+H2O。
=CO2↑+H2O。
②用离子方程式表示![]() 在阴极区再生的过程:______。
在阴极区再生的过程:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是
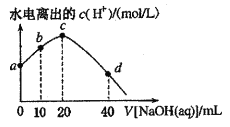
A. a点溶液中:c(H+)=6.0![]() 10-3mol
10-3mol![]() L-1
L-1
B. b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C. c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D. d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
A.氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2![]() =Mg2++2NH3H2O
=Mg2++2NH3H2O
B.沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
C.用食醋能清洗水垢:![]() +2CH3COOH=2CH3COO+H2O+CO2↑
+2CH3COOH=2CH3COO+H2O+CO2↑
D.84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
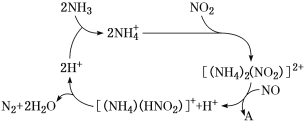
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题:
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如图所示。A包含物质为H2O和________(填化学式)。
(2)已知:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH1=-a kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的ΔH=________ kJ·mol-1。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)![]() HCN(g)+3H2(g) ΔH>0。
HCN(g)+3H2(g) ΔH>0。
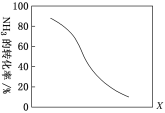
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是________(填字母)。
a.温度 b.压强 c.催化剂 d.![]()
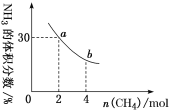
②在一定温度下,向2 L密闭容器中加入 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如下图所示。a点时,CH4的转化率为_______%;平衡常数:K(a)____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为Mb(aq)+O2(g) ![]() MbO2(aq),该反应的平衡常数可表示为K=
MbO2(aq),该反应的平衡常数可表示为K=![]() 。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示。[α=
。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示。[α=![]() ×100%]。研究表明正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。试求出图中c点时,上述反应的平衡常数K=________。已知k逆=60 s-1,则速率常数k正=________s-1。
×100%]。研究表明正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。试求出图中c点时,上述反应的平衡常数K=________。已知k逆=60 s-1,则速率常数k正=________s-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿(主要成分为的Sb2S3,还含有As2S5、PbS、CuO和SiO2等)为原料制备金属锑,其一种工艺流程如下:
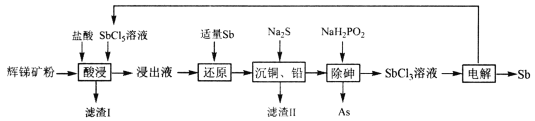
已知:I.浸出液主要含盐酸和SbC13,还含SbC15、CuC12、AsC13和PbC12等杂质。
II.25℃时,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(1)“酸浸”过程中SbC15和Sb2S3发生反应有一种单质和还原产物SbC13生成,则滤渣I的成分是_______________(填化学式)。
(2)写出“还原”反应的化学方程式_____________________。
(3)已知浸出液中c(Cu2+)=0.0lmol·L-1、c(Pb2+)=0.10mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_____________(填化学式);当CuS、PbS共沉时,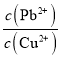 =_________。
=_________。
(4)在“除砷”过程中,氧化产物为H3PO4,则该反应中氧化剂、还原剂的物质的量之比为__________________。
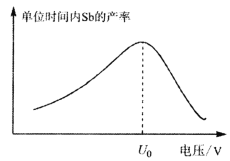
(5)在“电解”过程中,以惰性材料为电极,阳极的电极反应式为___________________,继而发生反应_________________(写出离子方程式)以实现溶液中Sb元素的循环使用。“电解”中单位时间内锑的产率与电压大小关系如图所示。当电压超过U0V时,单位时间内产率降低的原因可能是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com