
锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
(1)碱性:Sr(OH)2____Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是______________。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
①Ⅰ中,反应的化学方程式是__________________________________________________。
②Ⅱ中,能与盐酸反应溶解的物质有___________________________________________。
③Ⅳ的目的是__________________________________________。
④下列关于该工艺流程的说法正确的是________(填字母)。
a.该工艺产生的废液含较多的NH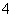 、Na+、Cl-、SO
、Na+、Cl-、SO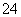
b.Ⅴ中反应时,升高温度一定可以提高SrCO3的生成速率
c.Ⅴ中反应时,加入溶液一定可以提高NH4HCO3的利用率
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )

A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端低B端高
D.当杠杆为导体时,A端高B端低
查看答案和解析>>
科目:高中化学 来源: 题型:
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并积极采取措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是__________(填字母)。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫化物沉降 | 化学法 |
| C | 含纯碱的废水 | 加石灰水反应 | 化学法 |
(2)下图是某市污水处理的工艺流程示意图:
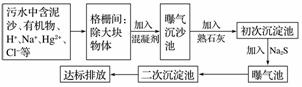
①下列物质中不可以作为混凝剂(沉降剂)使用的是____(填字母)。
A.偏铝酸钠 B.氧化铝
C.碱式氯化铝 D.氯化铁
②混凝剂除去悬浮物质的过程是________(填字母)。
A.物理变化 B.化学变化
C.既有物理变化又有化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:____________。
(2)[2012·浙江理综,26(1)]已知:I2+2S2O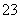 ===S4O
===S4O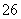 +2I-
+2I-
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入__________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=______________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验:①0.1 mol·L-1MgCl2溶液和0.2 mol·L-1NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;②向浊液a中滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀。下列分析不正确的是( )
A滤液b的pH=7
B.②中颜色变化说明Mg(OH)2转化为Fe(OH)3
C.实验可以证明Fe(OH)3的溶解度比Mg(OH)2的小
D.浊液a中存在沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产纯碱的工艺流程示意图如下:
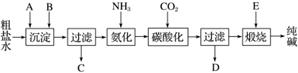
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式:A________,B________。
(2)实验室提纯粗盐的实验操作依次为取样、________、沉淀、________、________、冷却结晶、________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是_______________________
________________________________________________________________________。
碳酸化时没有析出碳酸钠晶体,其原因是__________________________________________
________________________________________________________________________。
(4)碳酸化后过滤,滤液D最主要的成分是______________________(填写化学式),检验这一成分的阴离子的具体方法是:_____________________________________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水时所发生的反应的离子方程式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
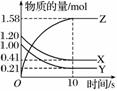
(1)从反应开始到10 s时,用Z表示的反应速率为__________,X的物质的量浓度减少了________,Y的转化率为______。
(2)该反应的化学方程式为______________________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是______。
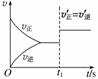
A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com