金属镁可用于制造合计、储氢材料、镁电池等.
已知:C(s)+
O
2(g)=CO(g)△H=-110.5kJ?mol
-1 Mg(g)+
O
2(g)=MgO(s)△H=-732.7kJ?mol
-1(1)一种制备镁的反应为:MgO(s)+C(s)=Mg(g)+CO(g),该反应的△H=
.
(2)一种用水氯镁石(主要成分为MgCl
2?6H
2O)制备金属镁工艺的关键流程如下:
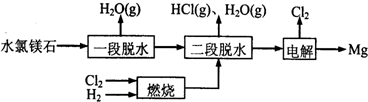
①为探究MgCl
2?6H
2O“一段脱水”的合理温度范围,某科研小组将MgCl
2?6H
2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如图所示(X-射线衍射可用于判断某晶态物质是否存在).

测得E中Mg元素质量分数为60.0%,则E的化学式为
.“一段脱水”的目的是制备MgCl
2?2H
2O,温度不高于180℃的原因是
.
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低点解效率,生成MgO的化学方程式为
.
③该工艺,可以循环使用的物质有
.
(3)Mg
2Ni是一中储氢材料,2.14g Mg
2Ni在一定条件下能吸收0.896L H
2(标准状况下)生成X,X的化学式为
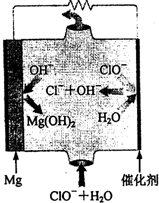
.“镁-次氯酸盐”燃料电池的装置如图,该电池反应的总反应方程式为
.