
| A. | Y与氢元素所形成的化合物分子只含有极性键 | |
| B. | W2Y、W2Y2中阴、阳离子个数比均为1:2 | |
| C. | Z的最高价氧化物对应水化物的酸性比R的强 | |
| D. | 将XY2通入W单质与水反应后的溶液中,生成的盐只有一种 |
分析 X、Y、Z、W、R为原子序数依次增大的五种短周期主族元素.X原子的最外层电子数是其内层电子数的2倍,则X为C元素;W+与Y2-具有相同的电子层结构,则Y为O,W为Na,R与Y可形成RY2、RY3化合物可知R为S,结合原子序数可知Z为F,以此来解答.
解答 解:由上述分析可知,X为C,Y为O,Z为F,W为Na,R为S,
A.Y与氢元素所形成的化合物结构式为H-O-O-H时,含非极性键,故A错误;
B.W2Y、W2Y2中阳离子均为钠离子,阴离子分别为氧离子、过氧根离子,阴、阳离子个数比均为1:2,故B正确;
C.Z为F,不存在最高价氧化物对应水化物,故C错误;
D.将XY2通入W单质与水反应后的溶液中,可能生成碳酸钠、碳酸氢钠,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、原子序数、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:填空题
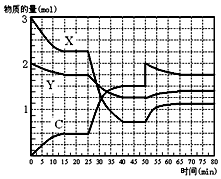 如图表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.下表是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
如图表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.下表是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).| 压强/Mpa C% 温度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.5 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 小苏打溶液与过量的澄清石灰水反应:Ca2++OH-+HCO${\;}_{3}^{-}$=CaCO3↓+H2O | |
| B. | 少量SO2通入氢氧化钠溶液中:OH-+SO2=HSO${\;}_{3}^{-}$ | |
| C. | 双氧水作脱氯剂,用于消除水中的氯气:Cl2+H2O2=2HCl+O2 | |
| D. | Fe3O4溶于氢碘酸的离子方程式:Fe3O4+8H+=2Fe3++Fe2++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
| D | 证明同温度下氯化银的溶解度大于硫化银的溶解度 | 向2 mL0.1 mol•L-1硝酸银溶液中加入1mL0.1mol•L-1 NaC1溶液,出现白色沉淀,再加入几滴0.1 mol•L-1的Na2S溶液,有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “天宫二号”使用的碳纤维,是一种新型有机高分子材料 | |
| B. | 施肥时,草木灰不能与铵盐混合使用,是因为它们之间发生反应会降低肥效 | |
| C. | 明矾常用作净水剂,是因为它能够消毒杀菌 | |
| D. | 14C可用于文物年代的鉴定,14C与12C互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y以1:1的原子个数比形成的化合物有多种 | |
| B. | W的最高价氧化物的水化物与Z的最高价氧化物的水化物之间不反应 | |
| C. | 含有元素W的盐溶液既能显酸性,也能显碱性 | |
| D. | 五种元素原子半径:Z>W>M>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 皮肤被紫外线灼伤 | B. | NaHCO3药片做抗酸药 | ||
| C. | 甘油做护肤保湿剂 | D. | 供能剂MgH2为氢能源汽车提供H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 亚硫酸钠溶液被空气中的氧气氧化:SO32-+O2═SO42- | |
| C. | 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 碳酸氢铵溶液和足量的氢氧化钠溶液混合加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
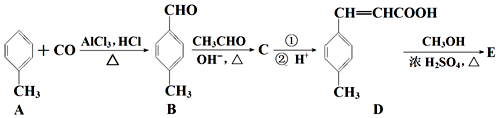
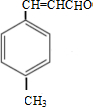 ;D→E的反应类型为酯化反应.
;D→E的反应类型为酯化反应.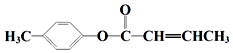 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为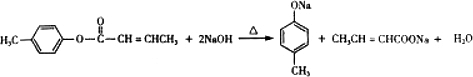 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com